Содержание
- История создания зрительного протеза
- Первые ретинальные импланты
- Тренды ретинальных имплантов: основные фундаментальные технологии
- Российский опыт ретинального протезирования
- Кортикальные системы имплантации
- Что такое ПХРД и ПВХРД?
- Причины возникновения дистрофий
- Симптомы периферических дистрофий
- Лечение периферических дистрофий сетчатки
- Причины возникновения
- Симптомы при разрыве сетчатки
- Методика диагностики
- Лечение макулярного разрыва сетчатки

Направления лечения
Заказать звонок 
Мы привыкли ассоциировать зрение лишь с глазами. Однако помимо самих глазных яблок в процессе участвует зрительная кора головного мозга, которой мы фактически «видим», и нервные пути, которые соединяют глаза с мозгом. Практически на каждом этапе можно попытаться реализовать протезирование.
История создания зрительного протеза
Немецкий психолог Иоганн Пуркинье в 1823 году заинтересовался вопросами зрения и галлюцинаций, а также возможностью искусственной стимуляции зрительных образов. Принято считать, что именно он впервые описал зрительные вспышки — фосфены, которые он получил при проведении простого опыта c аккумулятором, пропуская через голову электрический ток и описывая свой визуальный опыт.
Спустя 130 лет, в 1956 году, австралийский ученый Дж. И. Тассикер запатентовал первый ретинальный имплант, который не давал какого-то полезного зрения, но показал, что можно искусственно вызывать зрительные сигналы.
Ретинальный имплант (имплант сетчатки) «вводит» визуальную информацию в сетчатку, электрически стимулируя выжившие нейроны сетчатки. Пока вызванные зрительные восприятия имели довольно низкое разрешение, но достаточное для распознавания простых объектов.
Но глазное протезирование долго тормозилось из-за технологических ограничений. Прошло очень много времени, прежде чем появились какие-то реальные разработки, которые смогли дать «полезное зрение», то есть зрение, которым человек мог бы воспользоваться. В 2019 году в мире насчитывалось около 50 активных проектов, фокусирующихся на протезировании зрения.
Первые ретинальные импланты
Пару лет назад на рынке было доступно три ретинальных импланта, которые прошли клинические испытания и были сертифицированы государственными регулирующими органами: европейским CE Mark и американским FDA.
- Second Sight Medical Products, США
- Pixium Vision, Франция
- Retina Implant AG, Германия
Так выглядели первые ретинальные импланты
Бионические импланты — это целая система внешних и внутренних устройств.
IRIS II (Pixium Vision) и Argus II (Second Sight) имели внешние устройства (очки с видеокамерой и блок обработки видеосигнала). Слепой человек смотрит при помощи камеры, с нее картинка направляется в процессор, где изображение обрабатывается и распадается на 60 пикселей (для системы Argus II). Затем сигнал направляется через трансмиттер на электродную решетку, вживленную на сетчатке, и электрическим током стимулируются оставшиеся живые клетки.
В немецком импланте Alfa АMS (Retina Implant) нет внешних устройств, и человек видит своим собственным глазом. Имплант на 1600 электродов вживляется под сетчатку. Свет через глаз попадает на светочувствительные элементы и происходит стимуляция током. Питается имплант от подкожного магнитного коннектора.
Субретинальный имплантат Alpha AMS компании Retina Implant AG
Все три ретинальных импланта больше не производятся, так как появилось новое поколение кортикальных протезов (для стимуляции коры головного мозга, а не сетчатки глаза). Однако хотя проектов по фундаментальным разработкам по улучшению ретинальных имплантов еще много, ни один из них не прошел клинические испытания:
- Улучшенный имплант DRY AMD PRIMA компании Pixium с увеличением количества электродов для стимуляции большего количества клеток сетчатки проходит клинические испытания. Для участия в программе испытаний еще ищут пять кандидатов;
- Retina Implant AG закрыли производство;
- Second Sight проводят клинические испытания своего кортикального импланта, но в марте 2020 года компания уволила 80% сотрудников из эксплуатационно-производственного подразделения.
Тренды ретинальных имплантов: основные фундаментальные технологии
Ретинальные нанотрубки
Группа ученых из Китая (Shanghai Public Health Clinical Center) в 2018 году провела эксперимент на мышах, в ходе которого вместо не функционирующих фоторецепторов сетчатки предложила использовать нанотрубки. Преимущество этого проекта — маленький размер нанотрубок. Каждая из них может стимулировать только несколько клеток сетчатки.
Биопиксели
Группа ученых из Оксфорда стремится сделать протез максимально приближенным к естественной сетчатке. Биопиксели в проекте выполняют функцию, схожую с настоящими клетками. Они имеют оболочку из липидного слоя, в который встроены фоточувствительные белки. На них воздействуют кванты света и как в настоящих клетках изменяется электрический потенциал, возникает электрический сигнал.
Перовскитная искусственная сетчатка
Все предыдущие фундаментальные разработки направлены на стимулирование всех слоев живых клеток. При помощи технологии перовскитной искусственной сетчатки китайские ученые пытаются предоставить возможность не только получать световые ощущения, но и различать цвет за счет моделирования сигнала таким образом, чтобы он воспринимался мозгом как имеющий определенную цветность.
Фотогальваническая пленка Polyretina
В Polyretina используется маленькая пленка, покрытая слоем химического вещества, которое имеет свойство поглощать свет и конвертировать его в электрический сигнал. Пленка размещена на сферическом основании, чтобы можно было удобно разместить ее на глазном дне.
Фотогальванический имплант Polyretina
Субретинальное введение полупроводникового полимера
Итальянские ученые предлагают технологию введения полупроводникового полимерного раствора под сетчатку, при помощи которого свет фиксируется и трансформируется в электрические сигналы.
Российский опыт ретинального протезирования
В России в 2017 году при поддержке фондов «Со-единение» и «Искусство, Наука и Спорт» было приобретено и установлено два ретинальных импланта Argus II американской компании Second Sight. Это единственные операции по восстановлению зрения, которые были проведены в России за все время. Каждая операция вместе с реабилитацией стоила порядка 10 млн руб, а сама система имплантации для одного пациента — порядка $140 тыс. Все прошло успешно, и два полностью слепых жителя Челябинска — Григорий (не видел 20 лет) и Антонина (не видела 10 лет) — получили предметное зрение. Предметное зрение означает, что человек может видеть очертания предметов — дверь, окно, тарелку — без деталей. Читать и использовать смартфон они не могут. Оба пациента имели диагноз «пигментный ретинит» (куриная слепота).
На момент 2019 года в мире установлено около 350 имплантов, произведенных компанией Second Sight. Около 50 тысяч россиян нуждаются в подобном протезе сетчатки.
В России опытом в протезировании зрения может похвастаться лишь один проект — АНО Лаборатория «Сенсор-Тех».
«Трендом в фундаментальных разработках бионических протезов является стремление сделать их максимально безопасными, приближенными к биологическим тканям людей и с максимально возможным разрешением. Но настоящую революцию вызвали кортикальные импланты, и смысл в ретинальных имплантах пропал, так как они ставятся только при пигментном ретините и возрастной макулярной дегенерации при отсутствии ряда противопоказаний. Кортикальные же импланты значительно расширяют горизонт показаний и позволяют восстанавливать полезное зрение даже людям, вовсе лишенным глаз», — рассказал Андрей Демчинский, к.м.н., руководитель медицинских проектов АНО Лаборатория «Сенсор-Тех».
Кортикальные системы имплантации
Кортикальные протезы — это подгруппа визуальных нейропротезов, способных вызывать зрительные восприятия у слепых людей посредством прямой электрической стимуляции затылочной коры мозга, которая отвечает за распознавание изображений. Этот подход может быть единственным доступным лечением слепоты, вызванной глаукомой, терминальной стадией пигментного ретинита, атрофией зрительного нерва, травмой сетчатки, зрительных нервов и т.п. За последние пять лет ученые решили задачу создания такого внутрикортикального визуального нейропротеза, с помощью которого можно было бы восстановить ограниченное, но полезное зрение.
В 1968 году Г.С. Бридли и В.С. Левин провели первую операцию по установке кортикальных имплантов. Первый имплант состоял из шапочки с коннекторами (устанавливали на череп под кожу) и отдельной дуги с электродами (устанавливали под череп), которые стимулировали кору головного мозга. Эксперимент был проведен на двух добровольцах для оценки возможности получения полезного зрения. Позднее импланты были извлечены. Технология кортикальных имплантов была заморожена по причине провоцирования приступов эпилепсии при стимуляции большего количества клеток мозга.
Первый кортикальный имплант
Кортикальный имплант Orion
Спустя 45 лет американский лидер разработки ретинальных имплантов Second Sight создал кортикальную протезную систему ORION. В конце 2017 года Second Sight получили разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на проведение клинических испытаний. До апреля 2018 года было установлено шесть устройств. По результатам испытаний оказалось, что все пациенты ощущали зрительные стимулы, a у трех пациентов результаты были схожи с ретинальным имплантом Argus II и дали полезное предметное зрение. Клинические испытания будут проходить до июня 2023 года. Обязательным условием установки импланта является наличие у пациента зрительного опыта, то есть он может использоваться только для людей со сформированной зрительной корой, которые родились зрячими и потеряли зрение.
Система кортикальной имплантации Orion компании Second Sight
Кортикальный нейропротез CORTIVIS
Испанские ученые разработали кортикальный имплант под названием CORVITIS. Протез состоит из нескольких компонентов. Одна или две камеры обеспечивают получение изображения, которое затем обрабатывается биопроцессором, чтобы преобразовать визуальный образ в электрические сигналы. На втором этапе информация сводится в серию изображений и передается по радиочастотной связи на имплантированное устройство. Этот радиочастотный блок обеспечивает беспроводную передачу питания и данных во внутреннюю систему. Имплантированный электронный блок декодирует сигналы, определяет и контролирует форму напряжения и амплитуду формы волны, которая будет подаваться на соответствующие электроды. Клинические испытания на пяти пациентах завершатся в мае 2023 года.
Кортикальный имплант CORVITIS
Интракортикальный зрительный протез (WFMA)
Американские ученые разработали технологию многоканальной внутрикортикальной стимуляции с помощью беспроводных массивов металлических микроэлектродов и создали беспроводную плавающую микроэлектродную решетку (WFMA).
Система протеза состоит из группы миниатюрных беспроводных имплантируемых решеток-стимуляторов, которые могут передавать информацию об изображении, снятом на встроенную в очки видеокамеру, непосредственно в мозг человека. Каждая решетка получает питание и цифровые команды по беспроводной связи, так что никакие провода или разъемы не пересекают кожу головы. Посылая команды в WFMA, изображения с камеры передаются непосредственно в мозг, создавая грубое предметное визуальное восприятие изображения. Хотя восприятие не будет похоже на нормальное зрение, с его помощью человек может вести самостоятельную деятельность. Система ICVP получила одобрение FDA для проведения клинических испытаний.
Интракортикальный зрительный протез (WFMA)
Кортикальный протез NESTOR
Голландские ученые также разработали схожую технологию системы протезирования. Принцип функционирования протеза такой же, как в проектах выше. Камера отправляет сигнал на имплант, который состоит из тысяч электродов и смарт-чипа. С помощью процессора зрительное восприятие можно контролировать и регулировать.
«Хотя полное восстановление зрения пока кажется невозможным, кортикальные системы создают по-настоящему значимые визуальные восприятия, при помощи которых слепые люди могут распознавать, локализировать и брать предметы, а также ориентироваться в незнакомой среде. Результат — в существенном повышении уровня жизни слепых и слабовидящих. Такие вспомогательные устройства уже позволили тысячам глухих пациентов слышать звуки и приобретать языковые способности, и такая же надежда существует в области визуальной реабилитации», — обнадежил Андрей Демчинский.
Обновлено 14.08.2020 Лечением заболевания периферическая дистрофия сетчатки занимается офтальмолог Быстрый переход
Лечение периферических дистрофий
Периферические дистрофии (дегенерации) сетчатки –патологические изменения периферии глазного дна, которые могут приводить к разрывам и отслойке сетчатки.
Часто офтальмологи в диагнозах указывают следующие аббревиатуры: ПХРД или ПВХРД. По сути, этот набор букв говорит лишь о наличии «проблемы» на периферии сетчатки, а не сообщает о виде дистрофии и степени ее опасности.
Что такое ПХРД и ПВХРД?
ПХРД – периферическая хориоретинальная дистрофия
Этот вид дистрофии затрагивает непосредственно сетчатку глаза и его сосудистую оболочку (хориоидею). ПХРД считается благоприятным видом дистрофии, так как не несет никаких рисков для формирования тяжелого осложнения — отслойки сетчатки. Наиболее ярким представителем семейства ПХРД является дистрофия по типу «булыжной мостовой», представляющая собой безобидные единичные или множественные очаги хориоретинальной атрофии, разбросанные по периферии сетчатки.
ПВХРД – периферическая витреохориоретинальная дистрофия
В сравнении с ПХРД, ПВХРД считается неблагоприятным видом дистрофии, так как в патологическом процессе, помимо сетчатки и хориоидеи, задействовано стекловидное тело (лат. сorpus vitreum), которое плотно спаяно с зоной хориоретинальной дистрофии. Считается, что при таких условиях, как подъем тяжестей, резкое сотрясение тела или головы, роды, стекловидное тело может провоцировать разрыв сетчатки, тем самым увеличивая риски формирования ее отслойки. Но, к счастью, на деле все не так страшно, как привыкли считать. Большинство ПВХРД являются безобидными и требуют просто динамического наблюдения. Существуют виды ПВХРД, опасность которых в большинстве случаев сильно преувеличена. К ним относятся 2 вида дистрофий: решетчатая дистрофия (или «решетка») и «след улитки». Именно об этих двух видах дистрофии офтальмологи постоянно спорят.
«решетчатая» дистрофия дистрофия по типу «след улитки»
Причины возникновения дистрофий
До сих пор причины возникновения периферических дистрофий не определены. Они могут формироваться в любом возрасте, у мужчин и женщин, у людей с близорукостью, дальнозоркостью или отсутствием проблем со зрением. Стоит отметить, что данные дистрофии все же чаще встречаются у близоруких людей (миопов) и, чем больше близорукость выражена, тем выше вероятность их возникновения. Например, одной из причин этого явления увеличенный размер глазного яблока у близорукого человека — когда все оболочки глаза перерастянуты, ухудшается питание сетчатки в зоне экватора глаза. Опасные дистрофии, такие как «решетка» и «след улитки», встречаются всего у 6-12% всей популяции.
Симптомы периферических дистрофий
Как правило, большинство периферических дистрофий, включая опасные «решетку» и «след улитки», протекают абсолютно бессимптомно. В редких случаях человек может отмечать появление вспышек, сверканий, молний в глазу. Эти признаки являются неблагоприятными и определяют степень опасности дистрофии. Данные симптомы могут быть предвестниками разрывов сетчатки или знаком того, что разрывы уже сформировались. В случае появления темной «шторки», «занавеса» в проекции поля зрения, сгущения плавающих «мушек» перед глазами – следует незамедлительно обратиться к специалисту. Эти симптомы являются признаками отслойки сетчатки и требуют оказания медицинской помощи в срочном порядке.
Лечение периферических дистрофий сетчатки
Не существует методов профилактики возникновения периферических дистрофий. Кроме того, уже имеющиеся дистрофии не подлежат лечению при помощи лекарств, различных БАДов, глазных инъекций и капель. В качестве лечения рассматривается процедура проведения профилактической ограничительной лазерной коагуляции сетчатки.
В случае выявления периферической дистрофии сетчатки офтальмологами Рассвета будут даны рекомендации по последующему ведению этого состояния — в зависимости от вида дистрофии и степени ее опасности.
Мы не назначаем «поддерживающую» терапию витаминами, лекарствами, различными БАДами. Эти методы уже давно признаны бесполезными и неэффективными при лечении периферических дистрофий. При необходимости, по показаниям, будет рекомендована ограничительная лазерная коагуляция сетчатки.
В качестве лечения подразумевается проведение профилактической ограничительной лазерной коагуляции сетчатки.
Этот метод является своего рода профилактикой возникновения отслойки сетчатки в месте нахождения опасной ПВХРД, никак не влияя на саму ПВХРД: дистрофия никуда не исчезает и не «заживает». При помощи специального лазера на сетчатке, вокруг имеющейся дистрофии или сформированного разрыва сетчатки создаются так называемые лазеркоагуляты. В точках лазерного воздействия происходит «склеивание» сетчатки с подлежащими оболочками — таким образом создается защитный барьер, который в случае возникновения отслойки сетчатки в месте дистрофии будет препятствовать ее дальнейшему распространению.
до лазеркоагуляции после лазеркоагуляции
Важно: данная процедура не является 100% защитой от отслойки сетчатки в оперированном глазу.
Существует вероятность, что сформированные коагуляты не смогут «удержать» сетчатку на месте, или отслойка возникнет совсем в другом месте. Поэтому правильнее будет воспринимать этот метод в качестве профилактической меры, снижающей риски отслойки сетчатки, и полностью не исключать ее возникновения.
Так нужно ли делать ограничительную лазерную коагуляцию сетчатки?
Как уже упоминалось выше, в лечении нуждается лишь малая часть дистрофий. Большая же доля дистрофий требует контрольного наблюдения в динамике.
Решение в пользу проведения лазерного лечения принимается в случае наличия опасных ПВХРД, сопровождающихся клиническими симптомами: «вспышки», «молнии», «искры» в глазах. Как правило, именно такие ПВХРД и приводят к формированию разрывов сетчатки с риском ее отслоения в будущем. Если ПВХРД не сопровождается никакими симптомами, решение в пользу проведения лазеркоагуляции может быть все же принято, учитывая сопутствующие факторы риска: отслойку сетчатки в наследственном анамнезе или на парном глазу, высокую степень близорукости, большую протяженность дистрофии, перенесенные травмы или операции на глазах и т.д.
Как лечат периферические дистрофии в клинике Рассвет?
Большинство дистрофий клинически себя не проявляют. Поэтому важно обращаться к офтальмологу и для профилактики этих патологий.
Наши офтальмологи проведут все необходимые обследования, включая осмотр сетчатки с широким зрачком, а также осмотр с использованием специальной диагностической трехзеркальной линзы Гольдмана для визуализации самой отдаленной периферии сетчатки. В случае выявления опасных дистрофий определят дальнейшую тактику ведения — контрольные осмотры в динамике или ограничительную лазеркоагуляцию сетчатки.
Мы не пугаем байками об отслойке сетчатки, не запрещаем заниматься спортом, самостоятельно рожать только по причине наличия близорукости или иной неопасной дистрофии.
Решение о дальнейшей тактике ведения принимается индивидуально в каждом конкретном случае с учетом всех сопутствующих факторов.
Макула – центр сетчатки глаза, который также называют «желтым пятном». Здесь локализованы основные фоторецепторы и происходит фокусировка световых лучей. Чем опасен макулярный разрыв сетчатки, становится ясно, если учесть, что макула отвечает за центральное зрение. При ее повреждении в центре поля зрения формируется черное пятно, что ухудшает жизнь пациента. В Международном центре охраны здоровья проводится диагностика и качественное лечение заболевания с применением новейших технологий в офтальмологии.
Причины возникновения
Макула – округлая область сетчатки, находящаяся на заднем полюсе глаза. Она окрашена в желтый тон благодаря каротиноидам, лютеину и зеаксантину. Макула лишена сосудов, но в ней сосредоточены особые фоторецепторы – колбочки. Свет фокусируется на них, проходя через зрачок.
К поверхности сетчатой оболочки прикреплен каркас стекловидного тела, состоящий из коллагеновых фибрилл. С возрастом стекловидное тело подвергается структурным изменениям, сжимается и отрывается от сетчатой оболочки, создавая тракции в ее центральной части. Впоследствии формируются надрывы, фоторецепторы атрофируются, острота зрения снижается.
Распространенные причины макулярного разрыва:
- Изменения, происходящие непосредственно в структуре стекловидного тела, происходящие с возрастом;
- травмы глаза или головы;
- гипертония;
- тяжелые физические нагрузки;
- стрессы;
- дегенеративная миопия.
Большинство пациентов, столкнувшихся с макулярным разрывом сетчатки, задают вопрос, серьезно ли это. Если лечение макулы начато своевременно, удается повысить остроту зрения. При отсутствии терапии появляются дефекты непосредственно в поле зрения.
Симптомы при разрыве сетчатки
Клинические проявления данного заболевания будут зависеть от стадии его развития. Патология чаще диагностируется при обнаружении повреждения макулы на другом глазу. На стадии предразрыва пациент не чувствует дискомфорта.
Часто встречающиеся признаки разрыва макулы:
- падение остроты зрения;
- искаженные предметы или линии;
- трудности при чтении, проявляются, как будто строчки сливаются или «выпадают» буквы;
- яркие вспышки;
- ощущение пелены;
- изменение цветовосприятия.
Но перечисленной симптоматики офтальмологу недостаточно для постановки диагноза. Потребуется ряд инструментальных исследований.
Методика диагностики
В нашем центре вы можете записаться на прием к офтальмологу в удобное время. Врач соберет анамнез и проведет осмотр. Для подтверждения диагноза назначаются дополнительные исследования зрения:
- визометрия (метод, определяющий остроту зрения);
- биомикроскопия (диагностика с использованием щелевой лампы, проводится только после расширения зрачка);
- УЗИ в В-режиме (позволяет выводить на экран двухмерное изображение анатомических структур);
- тонометрия (измеряется внутриглазное давление);
- тест Амслера (назначается при искажении линий, центральной скотоме, микропсии);
- оптическая когерентная томография (информативный метод, позволяющий получать 3D изображения).
На основании полученных данных офтальмолог способен поставить диагноз и назначить лечение.
Лечение макулярного разрыва сетчатки
Для лечения разрыва макулы прибегают к хирургическим методам. Наиболее эффективный способом лечения является витрэктомия. В процессе вмешательства удаляется стекловидное тело и внутренняя пограничная мембрана, затем вводится специальный газ, благодаря этому сетчатка плотно прилегает к сосудистой оболочке.
В нашем центре проводится высокотехнологическое хирургическое вмешательство для лечения макулярного разрыва. После операции офтальмохирург наблюдает за состоянием пациента, дает рекомендации во время реабилитационного периода.
В зависимости от концентрации газ рассасывается от 2 недель до 1 месяца, и человек может вернуться к привычному образу жизни. В это время пациент обязан закапывать препараты с антибиотиками, избегать физических нагрузок, чтобы предотвратить осложнения.
Записаться на прием для лечения разрыва макулы вы можете по указанному телефону. Операторы подберут для вас удобное время.
2513 20 Октября
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
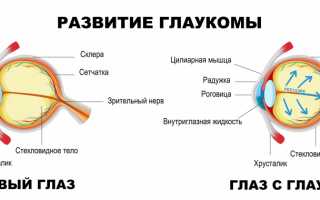
Глаукома: причины появления, симптомы, диагностика и способы лечения. Определение Глаукома – это не одно заболевание, а целая группа серьезных заболеваний органа зрения со схожими признаками:
- повышением внутриглазного давления (может быть постоянным или эпизодическим);
- поражением и последующей атрофией зрительного нерва;
- снижением остроты зрения, нарушением зрительных функций.
Пространство глаза, заполненное прозрачной жидкостью и ограниченное с одной стороны роговицей, а с другой – радужкой, называют передней камерой. В ней есть область, именуемая углом передней камеры, в наружной стенке которого находится дренажная система глаза, обеспечивающая контролируемый отток внутриглазной жидкости.Циркуляция жидкости поддерживает внутриглазное давление на постоянном уровне, а нарушение ее функции влечет за собой его рост.Внутриглазное давление считается основным фактором оценки здоровья пациентов, которые находятся в группе риска развития глаукомы. В норме давление в глазу составляет 18-24 мм рт. ст. При глаукоме баланс формирования внутриглазной жидкости и ее оттока нарушается, внутриглазное давление повышается, что приводит к атрофии глазного зрительного нерва. 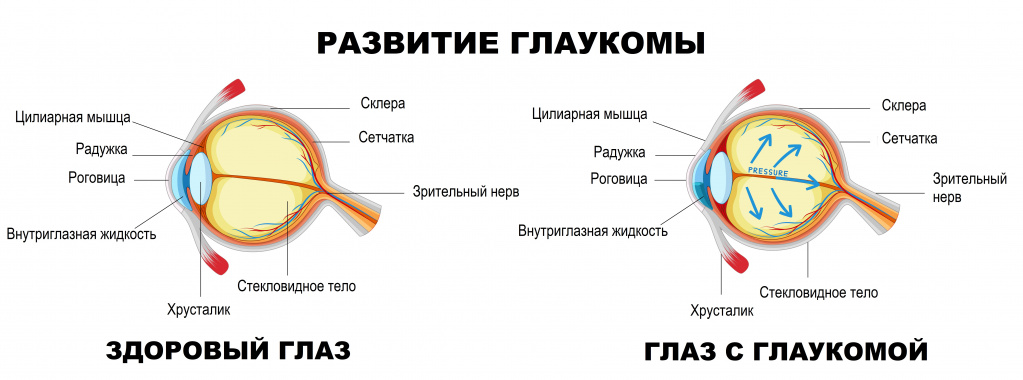
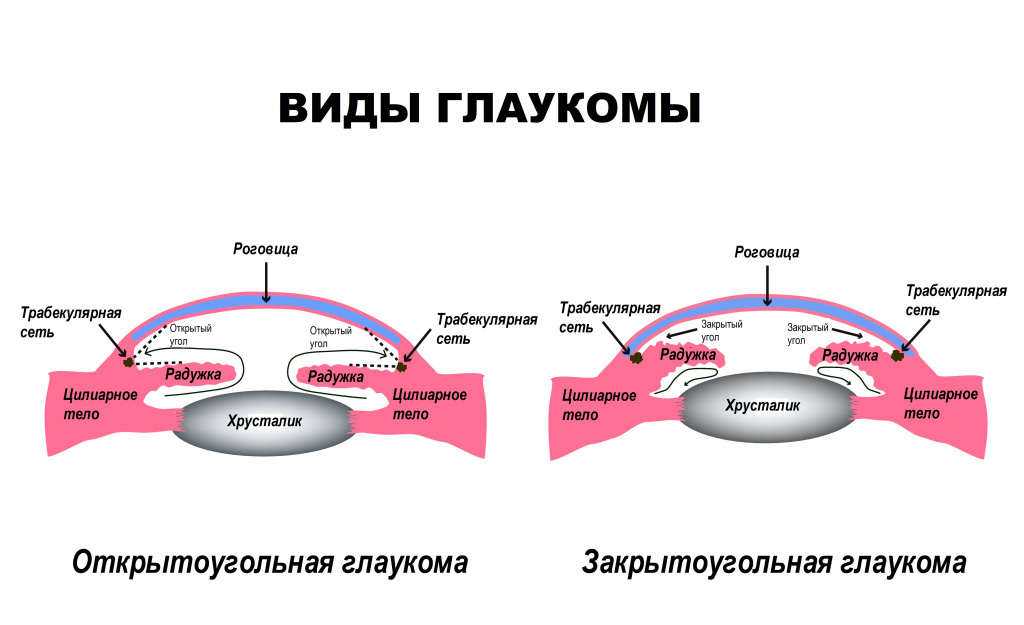
- возраст старше пятидесяти лет;
- периодически повышающееся внутриглазное давление;
- высокая степень близорукости после 40-50 лет;
- высокая степень дальнозоркости (особенно женщины после 50 лет);
- низкое артериальное давление;
- травмы глаз, воспалительные заболевания глаз (увеиты, иридоциклиты и др.), операции на глазах;
- хронические болезни глаз;
- сахарный диабет, ожирение;
- дисфункции гормональной и нервной систем;
- заболевания сердечно-сосудистой системы;
- хронический стресс;
- наследственная предрасположенность;
- длительный прием определенных лекарственных препаратов (гормональных препаратов, антигистаминных средств, антидепрессантов и т.д.).
Согласно данным ВОЗ, глаукома является ведущей патологией зрительного аппарата, приводящая к потере зрения.В России количество заболевших оценивается примерно в миллион человек. При этом глаукома – вторая по распространенности причина слепоты, она уступает лишь катаракте. Классификация заболевания По происхождению:
- первичная глаукома, при которой изменения циркуляции внутриглазной жидкости возникают первично, а симптомы формируются вторично;
- вторичная глаукома развивается на фоне иной глазной патологии или соматических заболеваний. Всегда имеются органические причины, которые нарушают внутриглазное давление.
По уровню внутриглазного давления:
- гипертензивная глаукома – при повышенном уровне внутриглазного давления;
- нормотензивная глаукома – плохо изученный тип глазной патологии, при которой повреждение зрительного нерва возникает, когда внутриглазное давление находится в норме.
По течению заболевания:
- стабилизированная глаукома — при продолжительном наблюдении за больным (не менее 6 месяцев) не обнаруживаются ухудшения в состоянии поля зрения и диска зрительного нерва;
- нестабилизированная глаукома — ухудшения в состоянии поля зрения и диска зрительного нерва регистрируют при повторных исследованиях. Оценивая динамику глаукоматозного процесса, принимают во внимание также уровень внутриглазного давления и его соответствие «целевому» значению.
По степени поражения зрительного нерва: Стадия I (начальная) — нет видимых изменений. Пациент, как правило, не предъявляет жалоб. Выявляют заболевание на этой стадии обычно на профилактическом визите у офтальмолога. Стадия II (развитая) — именно на этой стадии чаще всего выявляется глаукома, когда поражены уже более 60% волокон зрительного нерва. Уровень внутриглазного давления более высокий. Наблюдается существенное (более 10%) сужение поля зрения с носовой стороны. Стадия III (далеко зашедшая) — характеризуется выраженными изменениями зрительного нерва, сужением полей зрения, которое составляет менее 15% от точки фиксации, экскавацией (углублениями различной формы и размера) диска зрительного нерва. Стадия IV (терминальная) — полная потеря остроты и поля зрения или сохранение светоощущения с неправильной проекцией. Иногда сохраняется небольшой островок поля зрения в височном секторе. Экскавация тотальная. Врач констатирует полную атрофию зрительного нерва. Отмечаются очень высокие цифры внутриглазного давления. По возрасту пациента:
- врожденная глаукома (до 3 лет);
- инфантильная глаукома (от 3 до 10 лет);
- ювенильная глаукома (от 11 до 35 лет);
- глаукома взрослых (старше 35 лет).
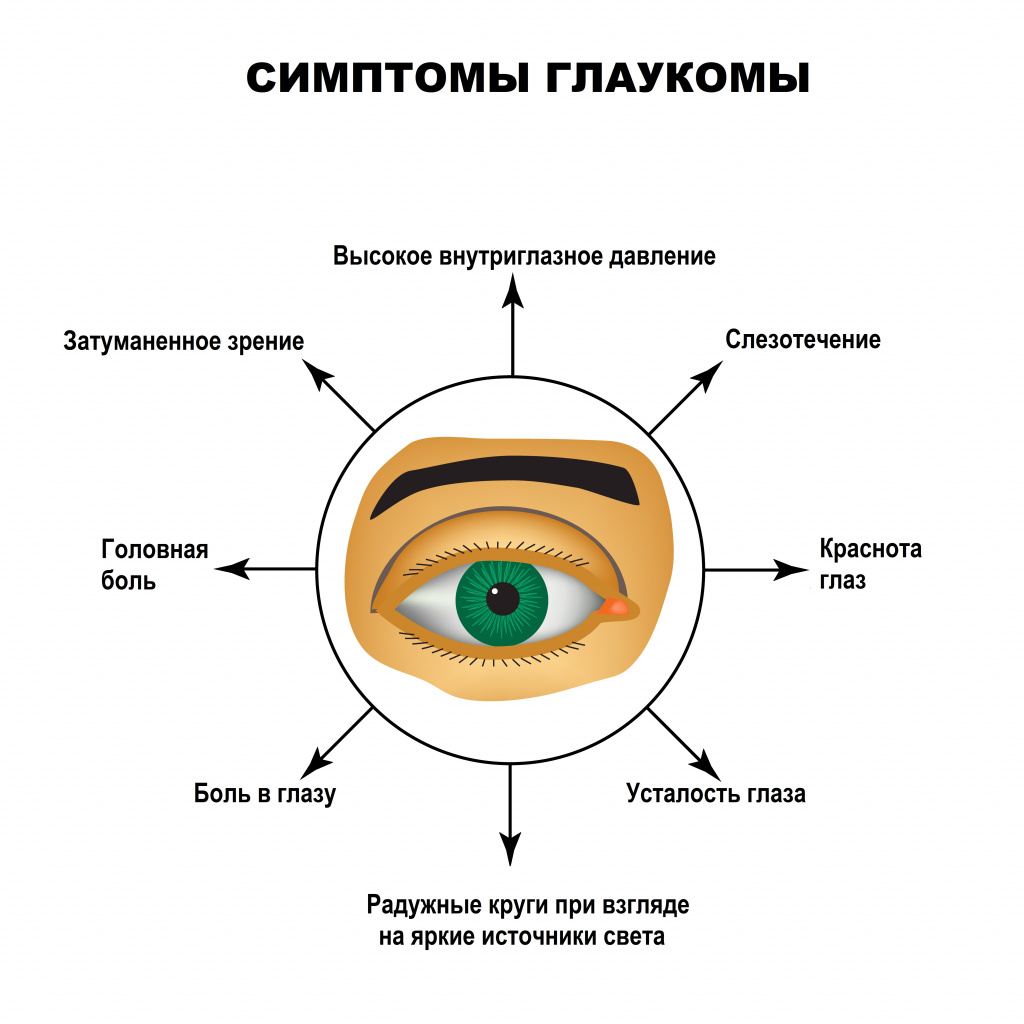
Симптомы глаукомы Основные симптомы заболевания:
- появление так называемых радужных кругов вокруг источников света;
- затуманивание и концентрическое (от периферии к центру) сужение бокового зрения;
- спорадически возникающие головные боли;
- боль в глазу;
- резкое снижение остроты зрения за очень короткий период времени;
- периодически возникающее чувство рези, болезненности и тяжести в области пораженного глаза;
- уменьшение поля зрения;
- снижение зрения в сумерках и ночью;
- влажность глаз;
- гиперемия глазного яблока.
- неспровоцированная острая боль в глазу;
- радужные круги и катастрофическое снижение остроты зрения у пораженного глаза;
- головная боль в лобной и височной областях со стороны больного глаза;
- внезапные позывы тошноты и рвота;
- брадикардия.
Диагностика глаукомы Для раннего выявления патологических процессов измеряют внутриглазное давление, исследуют глазное дно и диск зрительного нерва, проводят исследование поля зрения для выявления дефектов центрального и периферического зрения. Тонометрия проводится во время первичной диагностики неоднократно, при дальнейшем наблюдении – при каждом контрольном осмотре офтальмолога. С целью диагностики глаукомы может быть назначено комплексное обследование:
- исследование поля зрения (при помощи компьютерного периметра);
- измерение рефракции (способности оптической системы глаза преломлять световые лучи);
- измерение внутриглазного давления;
- ультразвуковые исследования;
- определение глубины передней камеры глаза и толщины хрусталика (так как зачастую причиной высокого давления является смещение или увеличение хрусталика);
- определение толщины роговицы;
- биомикроскопические исследования
- с помощью гониоскопии оценивается строение угла передней камеры, через который осуществляется отток жидкости из глаза.
Определение генетической предрасположенности к развитию заболевания: