Содержание
Дата обновления: 2021-12-01
Эндокринная офтальмопатия (ЭОП) — воспаление и отёк мягких тканей ретробульбарного пространства, возникающих в результате аутоиммунной патологии щитовидной железы. Следствием этого является ряд офтальмологических симптомов, среди которых сильнее всего выделяется пучеглазие — яркий симптом Базедовой болезни (болезнь Грейвса, диффузный токсический зоб).

Эндокринная офтальмопатия считается осложнением Базедовой болезни. По статистике, это состояние диагностируется у 25% пациентов с диффузным токсическим зобом. В 6% случаев наблюдается её тяжелая форма. У 0,3% пациентов эндокринная офтальмопатия сопровождается серьёзным риском потери зрения из-за поражения зрительного нерва.
У 20% пациентов пучеглазие и другие признаки офтальмопатии являются первыми симптомами Базедовой болезни. В 85% случаев между началом диффузного токсического зоба и возникновением офтальмопатии проходит не более 18 месяцев. Поражение ретробульбарной клетчатки и глазодвигательных мышц носит двухсторонний характер, с небольшим различием в выраженности симптомов. Только в 15% случаев офтальмопатия затрагивает один глаз. Чаще всего это осложнение диагностируется у женщин. Однако у мужчин симптомы офтальмопатии, как правило, более выражены и чаще приводят к тяжёлым последствиям.
Классификация эндокринной офтальмопатии
В зависимости от степени вовлечения мягких тканей глазницы в процесс различают следующие классы патологии:
- 0 класс — симптомы офтальмопатии отсутствуют;
- 1 класс — начальные признаки офтальмопатии: ретракция верхнего века, его отставание при закрытии глаза. Эти изменения делают взгляд больного удивлённым, пристальным или злобным;
- 2 класс — изменения мягких тканей глаза: отёк конъюнктивы, век, инъекция слизистой конъюнктивальной полости, склеры;
- 3 класс — визуально определяется проптоз глаза (пучеглазие);
- 4 класс — признаки вовлечения глазодвигательных мышц: двоение в глазах;
- 5 класс — патологические изменения роговицы (кератопатия, язва роговицы) глаза из-за лагофтальма (невозможность сомкнуть веки полностью из-за выпячивания глазного яблока);
- 6 класс — резкое снижение остроты зрения из-за вовлечения в патологический процесс зрительного нерва.
Клиническая классификация использует шкалу Европейской группы по изучению офтальмопатии Грейвса, позволяющую оценить степень активности патологии:
- спонтанная ретробульбарная боль;
- боль при взгляде верх или вниз;
- покраснение век;
- инъекция конъюнктивы;
- отек век;
- хемоз;
- воспаление карункулы.
Каждый пункт равен 1 баллу. При наличии 3 и более баллов ЭОП считается достаточно активной. Потеря зрения — самое тяжёлое осложнение, к которому может приводить эндокринная офтальмопатия, симптомы, возникающие при этом (прогрессирующее снижение зрения и/или повреждение роговицы глаза) является признаком тяжёлого течения патологии и требуют экстренного лечения. В противном случае возможны необратимые изменения в зрительном нерве и сетчатке, приводящие к слепоте.
Прогноз
Эндокринная офтальмопатия поддаётся лечению у большинства пациентов. Реальная угроза потери зрения при адекватной терапии возникает только у 0,3% больных. При своевременной диагностике и грамотном лечении прогноз благоприятный. Проблемы возникают у пациентов, обратившихся поздно, или лечившихся у офтальмологов (проявления ЭОП часто принимают за различные офтальмологические заболевания — конъюнктивиты, блефариты, инородные тела и т.п.). По этой причине требуется специализированная терапия в профильном лечебно-профилактическом учреждении всем больным с диагнозом эндокринная офтальмопатия.
Узнайте, в каких клиниках проводят лечение эндокринной офтальмопатии в Москве, на нашем сайте.
Причины эндокринной офтальмопатии
Причина эндокринной офтальмопатии связанна с основным заболеванием — диффузным токсическим зобом или болезнью Грейвса-Базедова-Флаяни. Это аутоиммунное воспаление щитовидной железы, протекающее с диффузным увеличением её объема и массы (зоб), возникающее в результате действия аутоантител к рецептору тиреотропного гормона.
Тиреотропный гормон или ТТГ — гормон гипофиза, стимулирующий секрецию трийодтиронина (Т3) и тироксина (Т4) щитовидной железой. В норме увеличение его уровней способствует росту концентрации тиреоидных гормонов в периферической крови и тканях. Снижение уровня ТТГ приводит к понижению секреции гормонов щитовидки. Таким образом осуществляет регуляция эндокринной функции железы.
Особенность диффузного токсического зоба в нарушении этого механизма из-за аутоиммунного процесса. По непонятным до конца причинам иммунная система начинает интенсивно продуцировать антитела к тканям щитовидной железы. Группа таких аутоантител специфична против рецепторов к тиреотропному гормону, имеющихся на поверхности мембраны фолликулярных клеток щитовидки (анти-рТТГ). Эти антитела присоединяются к рецептору, и из-за похожей структуры начинают оказывать стимулирующее воздействие на ткани щитовидной железы. В результате резко увеличивается секреция тиреоидных гормонов, что приводит к вторичному гипертиреозу (тиреотоксикозу).
Клетки соединительной и жировой ткани глазницы также имеют рецепторы к тиреоидному гормону, из-за чего они могут быть целью повреждающего действия аутоантител при Базедовой болезни. В результате возникает отёк глазодвигательных мышц и ретробульбарной клетчатки, давление в глазнице возрастает, из-за чего глаз фактически выдавливается наружу, подобно пробке в бутылке шампанского. Отёк также нарушает венозный отток, из-за чего страдает и сам глаз. По такому механизму возникает эндокринная офтальмопатия, лечение этой патологии может представлять трудности и требует обязательной терапии основного заболевания.
Симптомы эндокринной офтальмопатии
Разными учёными описано более 30 признаков и симптомов ЭОП. В основном причиной их возникновения считают отёк и воспаление мягких тканей орбиты. Клинически наиболее значимые симптомы:
- выпячивание глазного яблока (пучеглазие) — проптоз;
- появление полоски склеры между краем радужки и веком сверху — признак Кохера;
- расширение глазной щели из-за спазма век, придающее взгляду удивлённый вид — признак Дальримпля;
- дрожание закрытых век — признак Розенбаха;
- редкое или моргание — признак Штельвага;
- отставание или неподвижность верхнего века при взгляде вниз — признак Грефе;
- невозможность полностью сомкнуть веки — лагофтальм;
- отёк век — признак Энрота.
Неспецифические симптомы ЭОП включают в себя:
- распирающие боли за глазами, усиливающиеся при движении глазного яблока;
- чувство «песка» или инородного тела в глазах;
- слезотечение;
- фотофобия;
- пелена перед глазами, двоение;
- покраснение склёры глаза, конъюнктивы, сосудистая инъекция.
Неспецифические симптомы могут возникать из-за лагофтальма — неполное смыкание век приводит к раздражению роговицы, лишённой защиты от пересыхания и попадания инородных тел. В тяжёлых случаях следствием этого является кератопатия, кератит или язва роговицы. Лагофтальм увеличивает риск инфицирования конъюнктивы и склеры.
Нарушение венозного оттока может приводить к увеличению внутриглазного давления, из-за чего больные жалуются на боли в глазах, головные боли. По этой же причине возникают застойные явления в сетчатке, отёк зрительного нерва, ретинопатия. Ущемление или сдавливание зрительного нерва приводит к снижению зрения, сужению полей зрения, исчезновению роговичного рефлекса и потере цветового зрения. Эти признаки свидетельствуют о тяжёлой ЭОП. Степень проптоза варьирует. Его выраженность можно измерить в миллиметрах с помощью специального прибора — экзофтальмометра. При значительном экзофтальме возможен подвывих глазного яблока, приводящем к повреждению зрительного нерва.
Двоение в глазах является признаком миопатии глазодвигательных мышц. Из-за их воспаления могут быть ограничены движения глазного яблока. В начале заболевания эти симптомы могут возникать периодически, однако с течением времени приобретают хронический характер.
Особенность ЭОП — связь с табакокурением. У курящих пациентов симптомы и тяжесть патологии намного более выражены, по сравнению с некурящими. Риск возникновения глазных осложнений тиреотоксикоза у таких больных выше в 5 раз. Отказ от курения является обязательным требованием перед началом лечения, так как облегчает терапию и улучшает прогноз.
Обнаружили симптомы данного заболевания? Звоните +7 (495) 324-88-22 Наши специалисты проконсультируют Вас!
Диагностика эндокринной офтальмопатии
Диагностика ЭОП основывается на характерных признаках заболевания, которыми сопровождается эндокринная офтальмопатия. Симптомы, характерные для неё, хорошо известны любому врачу-эндокринологу. Но в некоторых случаях проптоз является признаком других патологий глазницы — опухолей, воспаления ретробульбарной клетчатки из-за инфекции, кровоизлияния, переломов глазницы, объёмных образований и т.д. По этой причине диагностика обязательно дополняется лабораторными и инструментальными исследованиями.
Лабораторная диагностика ЭОП
Лабораторная диагностика ЭОП проводится для оценки тиреоидного статуса пациента (гипертиреоз, гипотиреоз, эутиреоз), определения уровней тиреотропного гормона. Высокий уровень тиреоидных гормонов или тиреотоксикоз, низкий уровень ТТГ подтверждает эндокринную природу патологии. Затем проводится анализ крови на аутоантитела к рецепторам ТТГ, тиреоглобулину и тиреопероксидазе. При положительном результате диагноз диффузного токсического зоба, а также эндокринной офтальмопатии, более чем вероятен.
Инструментальная диагностика ЭОП
Инструментальные исследования — УЗИ, МСКТ и МРТ проводят для исключения объёмных образований глазницы. При этом выявляются признаки диффузного отёка ретробульбарной клетчатки, изолированный или диффузный отёк глазодвигательных мышц, диагностируется компрессия зрительного нерва. Такие изменения могут определяться и у пациентов без явных признаков патологии.
Лечение эндокринной офтальмопатии
Тактика лечения ЭОП зависит от тяжести состояния. При наличии угрозы потери зрения, ведётся агрессивная терапии, вплоть до хирургического вмешательства.
Лечение тяжёлой эндокринной офтальмопатии
Основой консервативной терапии тяжёлых форм ЭОП является системное назначение высоких доз глюкокортикостероидов (пульс-терапия) — преднизолона, метилпреднизолона. Предпочтительный метод введения препаратов — внутривенный (меньше осложнений, по сравнению с таблетированными средствами). Ретробульбарное введение ГКС не рекомендуется. Улучшение состояния наблюдается через 1–2 недели. При назначении глюкокортикостероидов необходимо учитывать вероятность рецидива после отмены препаратов (синдром отмены).
Существует много схем назначения глюкокортикостероидов при ЭОП. Доза препаратов варьирует от 60–80 мг в день, на протяжении нескольких месяцев, до 500 мг в неделю, на протяжении 6 недель, с последующим переходом на поддерживающую дозу или постепенную отмену. При отсутствии эффекта от системной гормональной терапии проводится хирургическая декомпрессия орбиты (удаляется часть костей глазницы).
Применение лучевой терапии на область орбиты имеет противоречивые сведения об эффективности у пациентов с диагнозом эндокринная офтальмопатия, лечение таким образом может привести к плохим результатам в долгосрочной перспективе. Суммарная доза облучения не должна превышать 20 грей. В целом, метод не считается приемлемой альтернативой глюкокортикостероидам.
Кератопатия или язва роговицы, возникающие как следствие неполного смыкания век, часто являются осложнением тяжёлой ЭОП. В таких случаях назначается местное лечение с помощью ежечасного нанесения антибактериальных, увлажняющих и заживляющих средств. Цель лечения — добиться полного закрытия глазной щели. В таких случаях декомпрессия орбиты является альтернативным способом предотвратить дальнейшее повреждение роговицы (с возможной перфорацией и потерей зрения).
При отсутствии эффекта от назначения ГКС возможно начало иммуносупрессивной терапии, подавляющей аутоиммунный процесс. Для лечения применяются циклоспорин, азатиоприн. Эффективность иммуносупрессивной терапии не доказана и многими учёнными считается терапией отчаяния — когда все возможные методы не дали эффекта.
Удаление щитовидной железы в сочетании с гормональной терапией или без у некоторых пациентов по эффективности сравнимо с назначением кортикостероидов. Однако однозначных рекомендаций и показаний к этому виду лечения нет.
Похожая тактика применяется и при ЭОП средней степени тяжести. В целом, даже такие экстремальные методы, как хирургическая декомпрессия, считаются достаточно безопасными. Лечение даёт положительный эффект у более чем 80% пациентов с тяжёлой офтальмопатией.
Лечение лёгкой ЭОП
У части больных офтальмопатия протекает в лёгкой форме. В таких случаях показанием к лечению с помощью глюкокортикостероидов является желание пациента улучшить свое качество жизни. В целом, для этой группы больных приём кортикостероидов не показан, так как риск их назначения превышает возможный положительный эффект. Вместо этого назначаются местные противовоспалительные препараты и средства, увлажняющие слизистую глаза.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу. 
Мы привыкли ассоциировать зрение лишь с глазами. Однако помимо самих глазных яблок в процессе участвует зрительная кора головного мозга, которой мы фактически «видим», и нервные пути, которые соединяют глаза с мозгом. Практически на каждом этапе можно попытаться реализовать протезирование.
История создания зрительного протеза
Немецкий психолог Иоганн Пуркинье в 1823 году заинтересовался вопросами зрения и галлюцинаций, а также возможностью искусственной стимуляции зрительных образов. Принято считать, что именно он впервые описал зрительные вспышки — фосфены, которые он получил при проведении простого опыта c аккумулятором, пропуская через голову электрический ток и описывая свой визуальный опыт.
Спустя 130 лет, в 1956 году, австралийский ученый Дж. И. Тассикер запатентовал первый ретинальный имплант, который не давал какого-то полезного зрения, но показал, что можно искусственно вызывать зрительные сигналы.
Ретинальный имплант (имплант сетчатки) «вводит» визуальную информацию в сетчатку, электрически стимулируя выжившие нейроны сетчатки. Пока вызванные зрительные восприятия имели довольно низкое разрешение, но достаточное для распознавания простых объектов.
Но глазное протезирование долго тормозилось из-за технологических ограничений. Прошло очень много времени, прежде чем появились какие-то реальные разработки, которые смогли дать «полезное зрение», то есть зрение, которым человек мог бы воспользоваться. В 2019 году в мире насчитывалось около 50 активных проектов, фокусирующихся на протезировании зрения.
Первые ретинальные импланты
Пару лет назад на рынке было доступно три ретинальных импланта, которые прошли клинические испытания и были сертифицированы государственными регулирующими органами: европейским CE Mark и американским FDA.
- Second Sight Medical Products, США
- Pixium Vision, Франция
- Retina Implant AG, Германия
Так выглядели первые ретинальные импланты
Бионические импланты — это целая система внешних и внутренних устройств.
IRIS II (Pixium Vision) и Argus II (Second Sight) имели внешние устройства (очки с видеокамерой и блок обработки видеосигнала). Слепой человек смотрит при помощи камеры, с нее картинка направляется в процессор, где изображение обрабатывается и распадается на 60 пикселей (для системы Argus II). Затем сигнал направляется через трансмиттер на электродную решетку, вживленную на сетчатке, и электрическим током стимулируются оставшиеся живые клетки.
В немецком импланте Alfa АMS (Retina Implant) нет внешних устройств, и человек видит своим собственным глазом. Имплант на 1600 электродов вживляется под сетчатку. Свет через глаз попадает на светочувствительные элементы и происходит стимуляция током. Питается имплант от подкожного магнитного коннектора.
Субретинальный имплантат Alpha AMS компании Retina Implant AG
Все три ретинальных импланта больше не производятся, так как появилось новое поколение кортикальных протезов (для стимуляции коры головного мозга, а не сетчатки глаза). Однако хотя проектов по фундаментальным разработкам по улучшению ретинальных имплантов еще много, ни один из них не прошел клинические испытания:
- Улучшенный имплант DRY AMD PRIMA компании Pixium с увеличением количества электродов для стимуляции большего количества клеток сетчатки проходит клинические испытания. Для участия в программе испытаний еще ищут пять кандидатов;
- Retina Implant AG закрыли производство;
- Second Sight проводят клинические испытания своего кортикального импланта, но в марте 2020 года компания уволила 80% сотрудников из эксплуатационно-производственного подразделения.
Тренды ретинальных имплантов: основные фундаментальные технологии
Ретинальные нанотрубки
Группа ученых из Китая (Shanghai Public Health Clinical Center) в 2018 году провела эксперимент на мышах, в ходе которого вместо не функционирующих фоторецепторов сетчатки предложила использовать нанотрубки. Преимущество этого проекта — маленький размер нанотрубок. Каждая из них может стимулировать только несколько клеток сетчатки.
Биопиксели
Группа ученых из Оксфорда стремится сделать протез максимально приближенным к естественной сетчатке. Биопиксели в проекте выполняют функцию, схожую с настоящими клетками. Они имеют оболочку из липидного слоя, в который встроены фоточувствительные белки. На них воздействуют кванты света и как в настоящих клетках изменяется электрический потенциал, возникает электрический сигнал.
Перовскитная искусственная сетчатка
Все предыдущие фундаментальные разработки направлены на стимулирование всех слоев живых клеток. При помощи технологии перовскитной искусственной сетчатки китайские ученые пытаются предоставить возможность не только получать световые ощущения, но и различать цвет за счет моделирования сигнала таким образом, чтобы он воспринимался мозгом как имеющий определенную цветность.
Фотогальваническая пленка Polyretina
В Polyretina используется маленькая пленка, покрытая слоем химического вещества, которое имеет свойство поглощать свет и конвертировать его в электрический сигнал. Пленка размещена на сферическом основании, чтобы можно было удобно разместить ее на глазном дне.
Фотогальванический имплант Polyretina
Субретинальное введение полупроводникового полимера
Итальянские ученые предлагают технологию введения полупроводникового полимерного раствора под сетчатку, при помощи которого свет фиксируется и трансформируется в электрические сигналы.
Российский опыт ретинального протезирования
В России в 2017 году при поддержке фондов «Со-единение» и «Искусство, Наука и Спорт» было приобретено и установлено два ретинальных импланта Argus II американской компании Second Sight. Это единственные операции по восстановлению зрения, которые были проведены в России за все время. Каждая операция вместе с реабилитацией стоила порядка 10 млн руб, а сама система имплантации для одного пациента — порядка $140 тыс. Все прошло успешно, и два полностью слепых жителя Челябинска — Григорий (не видел 20 лет) и Антонина (не видела 10 лет) — получили предметное зрение. Предметное зрение означает, что человек может видеть очертания предметов — дверь, окно, тарелку — без деталей. Читать и использовать смартфон они не могут. Оба пациента имели диагноз «пигментный ретинит» (куриная слепота).
На момент 2019 года в мире установлено около 350 имплантов, произведенных компанией Second Sight. Около 50 тысяч россиян нуждаются в подобном протезе сетчатки.
В России опытом в протезировании зрения может похвастаться лишь один проект — АНО Лаборатория «Сенсор-Тех».
«Трендом в фундаментальных разработках бионических протезов является стремление сделать их максимально безопасными, приближенными к биологическим тканям людей и с максимально возможным разрешением. Но настоящую революцию вызвали кортикальные импланты, и смысл в ретинальных имплантах пропал, так как они ставятся только при пигментном ретините и возрастной макулярной дегенерации при отсутствии ряда противопоказаний. Кортикальные же импланты значительно расширяют горизонт показаний и позволяют восстанавливать полезное зрение даже людям, вовсе лишенным глаз», — рассказал Андрей Демчинский, к.м.н., руководитель медицинских проектов АНО Лаборатория «Сенсор-Тех».
Кортикальные системы имплантации
Кортикальные протезы — это подгруппа визуальных нейропротезов, способных вызывать зрительные восприятия у слепых людей посредством прямой электрической стимуляции затылочной коры мозга, которая отвечает за распознавание изображений. Этот подход может быть единственным доступным лечением слепоты, вызванной глаукомой, терминальной стадией пигментного ретинита, атрофией зрительного нерва, травмой сетчатки, зрительных нервов и т.п. За последние пять лет ученые решили задачу создания такого внутрикортикального визуального нейропротеза, с помощью которого можно было бы восстановить ограниченное, но полезное зрение.
В 1968 году Г.С. Бридли и В.С. Левин провели первую операцию по установке кортикальных имплантов. Первый имплант состоял из шапочки с коннекторами (устанавливали на череп под кожу) и отдельной дуги с электродами (устанавливали под череп), которые стимулировали кору головного мозга. Эксперимент был проведен на двух добровольцах для оценки возможности получения полезного зрения. Позднее импланты были извлечены. Технология кортикальных имплантов была заморожена по причине провоцирования приступов эпилепсии при стимуляции большего количества клеток мозга.
Первый кортикальный имплант
Кортикальный имплант Orion
Спустя 45 лет американский лидер разработки ретинальных имплантов Second Sight создал кортикальную протезную систему ORION. В конце 2017 года Second Sight получили разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на проведение клинических испытаний. До апреля 2018 года было установлено шесть устройств. По результатам испытаний оказалось, что все пациенты ощущали зрительные стимулы, a у трех пациентов результаты были схожи с ретинальным имплантом Argus II и дали полезное предметное зрение. Клинические испытания будут проходить до июня 2023 года. Обязательным условием установки импланта является наличие у пациента зрительного опыта, то есть он может использоваться только для людей со сформированной зрительной корой, которые родились зрячими и потеряли зрение.
Система кортикальной имплантации Orion компании Second Sight
Кортикальный нейропротез CORTIVIS
Испанские ученые разработали кортикальный имплант под названием CORVITIS. Протез состоит из нескольких компонентов. Одна или две камеры обеспечивают получение изображения, которое затем обрабатывается биопроцессором, чтобы преобразовать визуальный образ в электрические сигналы. На втором этапе информация сводится в серию изображений и передается по радиочастотной связи на имплантированное устройство. Этот радиочастотный блок обеспечивает беспроводную передачу питания и данных во внутреннюю систему. Имплантированный электронный блок декодирует сигналы, определяет и контролирует форму напряжения и амплитуду формы волны, которая будет подаваться на соответствующие электроды. Клинические испытания на пяти пациентах завершатся в мае 2023 года.
Кортикальный имплант CORVITIS
Интракортикальный зрительный протез (WFMA)
Американские ученые разработали технологию многоканальной внутрикортикальной стимуляции с помощью беспроводных массивов металлических микроэлектродов и создали беспроводную плавающую микроэлектродную решетку (WFMA).
Система протеза состоит из группы миниатюрных беспроводных имплантируемых решеток-стимуляторов, которые могут передавать информацию об изображении, снятом на встроенную в очки видеокамеру, непосредственно в мозг человека. Каждая решетка получает питание и цифровые команды по беспроводной связи, так что никакие провода или разъемы не пересекают кожу головы. Посылая команды в WFMA, изображения с камеры передаются непосредственно в мозг, создавая грубое предметное визуальное восприятие изображения. Хотя восприятие не будет похоже на нормальное зрение, с его помощью человек может вести самостоятельную деятельность. Система ICVP получила одобрение FDA для проведения клинических испытаний.
Интракортикальный зрительный протез (WFMA)
Кортикальный протез NESTOR
Голландские ученые также разработали схожую технологию системы протезирования. Принцип функционирования протеза такой же, как в проектах выше. Камера отправляет сигнал на имплант, который состоит из тысяч электродов и смарт-чипа. С помощью процессора зрительное восприятие можно контролировать и регулировать.
«Хотя полное восстановление зрения пока кажется невозможным, кортикальные системы создают по-настоящему значимые визуальные восприятия, при помощи которых слепые люди могут распознавать, локализировать и брать предметы, а также ориентироваться в незнакомой среде. Результат — в существенном повышении уровня жизни слепых и слабовидящих. Такие вспомогательные устройства уже позволили тысячам глухих пациентов слышать звуки и приобретать языковые способности, и такая же надежда существует в области визуальной реабилитации», — обнадежил Андрей Демчинский.
Обновлено 14.08.2020
Глазодвигательный нерв – n. oculomotorius (III пара) – является смешанным нервом, содержит двигательные и парасимпатические волокна.
Двигательные волокна иннервируют наружные мышцы глаза: верхнюю прямую мышцу (движение глазного яблока вверх и кнутри); нижнюю прямую мышцу (движение глазного яблока вниз и кнутри); медиальную прямую мышцу (движение глазного яблока кнутри); нижнюю косую мышцу (движение глазного яблока кверху и кнаружи); мышцу, поднимающую верхнее веко.
Парасимпатическим волокнам иннервируют внутреннюю мышцу глаза – мышцу, суживающую зрачок (m. sphincter pupillae), отвечают за конвергенцию (сведение к центру) глазных осей и аккомодацию.
Симптомы поражения.
Птоз (опущение века) обусловлен параличом мышцы, поднимающей верхнее веко
Расходящееся косоглазие – установка глазного яблока кнаружи и слегка вниз в связи с действием не встречающих сопротивления латеральной прямой (иннервируется VI парой черепных нервов) и верхней косой (иннервируется IV парой черепных нервов) мышц.
Диплопия (двоение в глазах). Двоение возникает вследствие отклонения зрительной оси одного глаза относительно другого, при монокулярном зрении оно обусловлено, как правило, изменением свойств преломляющих сред глаза (катаракта, помутнение хрусталика).
Мидриаз (расширение зрачка) с отсутствием реакции зрачка на свет и аккомодацию; зрачок расширяется, так как сохраняется симпатическая иннервация. Исчезновение зрачкового рефлекса на свет происходит как на стороне поражения, так и на противоположной, поскольку прерывается сопряженность этой реакции. Если при этом свет падает на контралатеральный, непораженный глаз, то рефлекс зрачка на свет возникает с обеих сторон.
Паралич (парез) аккомодации обусловливает ухудшение зрения на близкие расстояния.
Паралич (парез) конвергенции глаз проявляется невозможностью повернуть глазные яблоки кнутри.
Блоковый нерв – n. trochlearis (IV пара) – иннервирует верхнюю косую мышцу, которая поворачивает глазное яблоко кнаружи и вниз.
Симптомы поражения. Паралич мышцы вызывает отклонение пораженного глазного яблока кверху и несколько кнутри. Это отклонение особенно заметно, когда пораженный глаз смотрит вниз и в здоровую сторону, и отчетливо проявляется, когда больной смотрит себе под ноги (при ходьбе по лестнице).
Отводящий нерв – n. abducens (VI пара) – иннервирует латеральную мышцу глаза, поворачивающую глазное яблоко кнаружи.
Симптомы поражения. Нарушается движение глазного яблока кнаружи. Это происходит потому, что медиальная прямая мышца остается без антагониста и глазное яблоко отклоняется в сторону носа (сходящееся косоглазие – strabismus convergens). Кроме того, возникает двоение в глазах, особенно при взгляде в сторону пораженной мышцы.
Паралич Белла (идиопатическая форма невропатии лицевого нерва – иннервирует мимические мышцы) – проявляется параличом мимических мышц, обусловленным поражением лицевого нерва. При попытке закрыть глаз веки на стороне поражения не смыкаются, глазное яблоко остается неприкрытым, отклоняется вверх и кнаружи, глазную щель при этом заполняет лишь склера (симптом Белла).
Симптомы поражения. Односторонний парез мимических мышц, слабость.
Больной не может поднять бровь на пораженной стороне, нахмурить ее, наморщить нос, плотно зажмурить глаз, надуть щеку, вытянуть губы трубочкой, свистнуть.
Тонус мышц на пораженной стороне снижен, щека “парусит”; изменение ширины глазных щелей; при оскаливании зубов ротовая щель перетягивается в здоровую сторону.
Из-за паралича круговых мышц глаз веки не смыкаются (лагофтальм – заячий глаз).
Пища застревает между щекой и десной, слеза может стекать по щеке, утрачивается вкус на передних 2/3 языка на стороне поражения, отмечается обострение слуха на той же стороне (гиперакузия). Иногда из-за отека охватывающий коленчатый узел, выключаются волокна, контролирующие слезную железу, что приводит к прекращению слезоотделения (синдром “сухого глаза”), чреватый возникновением кератита из-за лагофтальма.
Синдром верхней глазничной щели (также известный как Синдром Рошон-Дювиньо) — симптомокомплекс, возникающий вследствие поражения (воспалением или сдавлением) III (глазодвигательного), IV (блоковый), VI (отводящий) пар черепно-мозговых нервов, глазного нерва (1 ветви тройничного нерва), проходящих через одноимённую щель.
Верхняя глазничная щель (fissura orbitalis superior) образована телом клиновидной кости и ее крыльями, соединяет глазницу со средней черепной ямкой.
В глазницу проходят:
- три основные ветви глазного нерва ( ophthalmicus) — слезный, носоресничный и лобный нервы (nn. lаеrimalis, nasociliaris et frontalis) – определяют чувствительность глазного яблока;
- блоковый нерв (n.trochlearis). – определяет движение глазного яблока;
- отводящий нерв ( abducens) – определяет движение глазного яблока;
- глазодвигательный нерв ( oculomolorius) – определяет движение глазного яблока и верхнего века.
Глазницу покидает
- верхняя глазная вена ( ophthalmica superior). – определяет отток венозной крови из глазного яблока
При повреждениях этой области развивается характерный симптомокомплекс:
- полная офтальмоплегия, т. е. обездвиженность глазного яблока;
- птоз (опущение верхнего века);
- мидриаз (расширение зрачка);
- снижение тактильной чувствительности роговицы и кожи век;
- расширение вен сетчатки;
- нейропаралитический кератит;
- небольшой экзофтальм.
Однако “синдром верхней глазничной щели” может быть выражен не полностью, когда повреждены не все, а лишь отдельные нервные стволы, проходящие через эту щель.
Пальпебромандибулярная синкинезия Маркуса-Гунна.
При этом заболевании наблюдают поднятие век при каждом движении челюсти во время пережёвывания пищи. Лечение проводят при выраженном птозе и при наличии значительного движения века. Обнаруживают при рождении.
Этиология: синкинезия, вызванная врождённым нарушением нервных связей между волокнами глазодвигательного нерва, иннервирующими мышцу, поднимающую верхнее веко, и волокнами тройничного нерва, иннервирующими жевательные мышцы.
Как правило, первые признаки синдрома обнаруживают при кормлении младенца. Веко на стороне поражения при движениях челюсти во время кормления будет двигаться вверх и вниз.
Внешний вид пальпебромандибулярной синкинезии Маркуса-Гунна. Односторонний птоз со снижением функции мышцы, поднимающей верхнее веко. Последнее поднимается на стороне поражения при движениях челюсти. К поднятию века также приводит боковое смещение нижней челюсти в сторону, противоположную больному глазу.
Все лекции для врачей удобным спискомПоделиться:12 сентября 2021
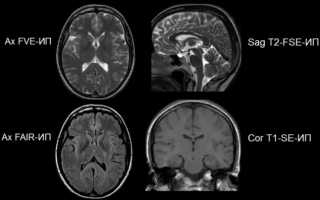
Лекция для врачей “МРТ черепных нервов” Лекцию для врачей проводит к. м. н. Трофимова Т. Н.
На лекции рассмотрены следующие вопросы:
- Актуальность
- Поражение черепных нервов, является одной из актуальных проблем неврологии и нейрохирургии
- Проблема выбора тактики лечения пациентов с симптомами дисфункции черепных нервов (ЧН)
- Обширный спектр заболеваний, приводящих к дисфункции черепных нервов (ЧН)
- Отсутствие стандартизированного комплекса диагностических исследований
- Визуализация и определение изменений черепных нервов (ЧН) и прилежащих структур были возможны интраоперационно или при аутопсии
- MPT вносит существенный вклад в решение этой задачи:
- безопасность
- высокая тканевая контрастность и разрешающей способности
- возможность получения изображений в различных плоскостях
- Методология
- высокая напряженность магнитного поля (1,5 Т)
- наличие ИП – FIESTA и SPGR, 3 плоскости
- пакет опций для постпроцессинговой обработки изображений (MPR, MIP)
- Уровни поражения
- ядра
- цистерны ствола и основания
- костные каналы
- кавернозный синус или верхняя глазничная щель
MPT с контрастированием
- MPT с контрастным усилением является ценным для обнаружения и дифференцировки изменений черепных нервов
- Патологическое усиление MP-сигнала от структур нерва и окружающих тканей на МРТ может иногда быть первым в определении основной причины заболевания
- 3D-SPGR-ИП + “С”
- очаги демиелинизации
- мелкие невриномы, менингиомы
- Постконтрастная МРА – дифференциация вазоневральной компрессии
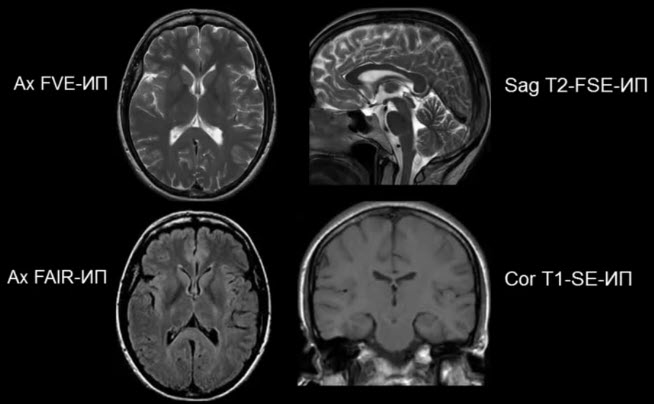
Стандартное исследование головного мозга
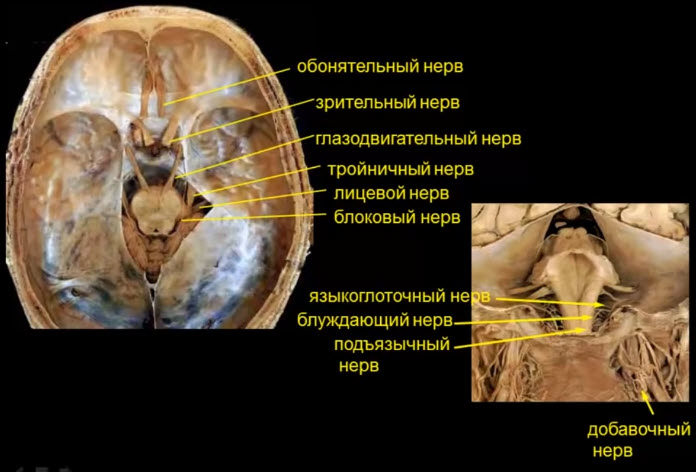
- Поражение III III IV V VI VII VIII IX XI XII черепных нервов
- Материалы и методы
- Комплексное клинико-лучевое обследование проведено 618 пациентам, из них 160 с невралгией тройничного нерва
- Клиническое обследование – невролог, нейрохирург, окулист, оториноларинголог, психиатр
- Инструментальное исследование
- Лучевая диагностика – краниография, КТ и КТА, МРТ и MPA, СКТ лицевого скелета
- Показания к МРТ
- Опухоли, кисты
- Демиелинизирующие процессы
- Воспалительные заболевания
- Цереброваскулярные заболевание
- Аномалии развития
- Показания к КТ
- Изучение костных каналов черепных нервов и их выходных отверстий
- СКТ- ангиография с визуализацией сосудов головного мозга и последующей объемной реконструкцией на фоне костей основания черепа
- Виртуальное планирование хирургического лечения
- Противопоказания для выполнения МРТ
- Методика лучевого исследования черепных нервов
- I этап – стандартное МРТ исследование головного мозга
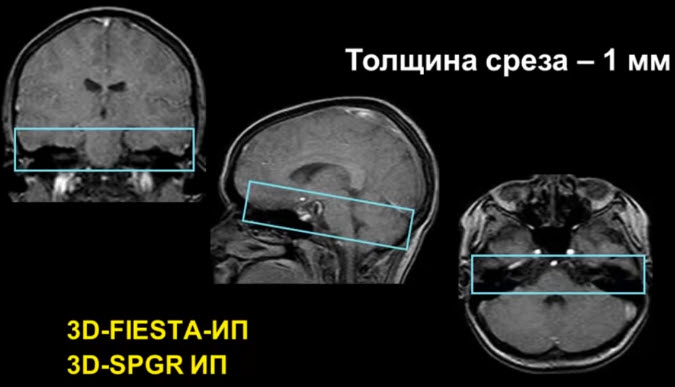
- II этап – специализированный протокол для изучения структур цистернальной части черепных нервов (3D-FIESTA ИП и 3D-SPGR ИП, толщина среза 1,00 мм)
- III этап – МРТ и МРА с контрастированием
- IV этап – стандартная методика СКТ с последующей объемной 3-D реконструкцией (тонкие срезы -1,5 мм)
- V этап – КТА
- Изучение структур цистернальной части черепных нервов
- Реформатирование
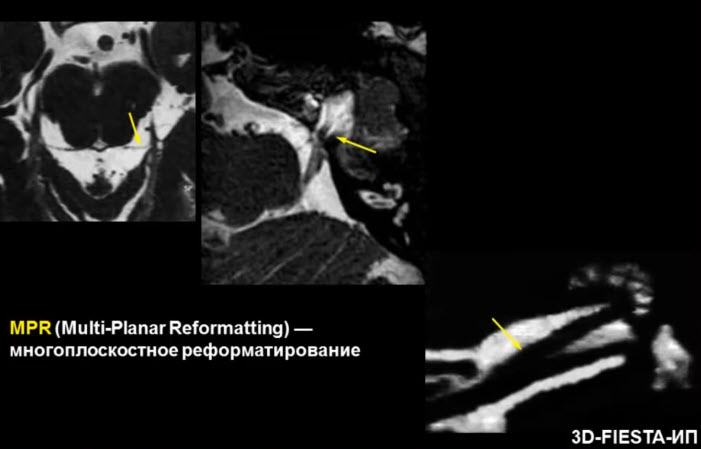
- МР ангиография

- I – обонятельный нерв
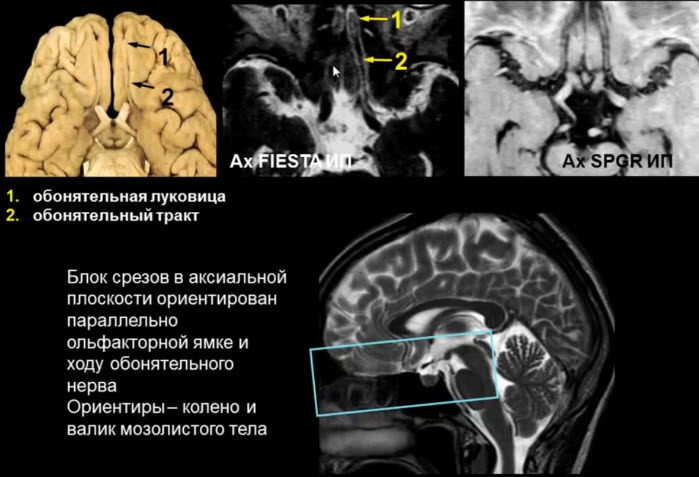
- Эстезионейробластома
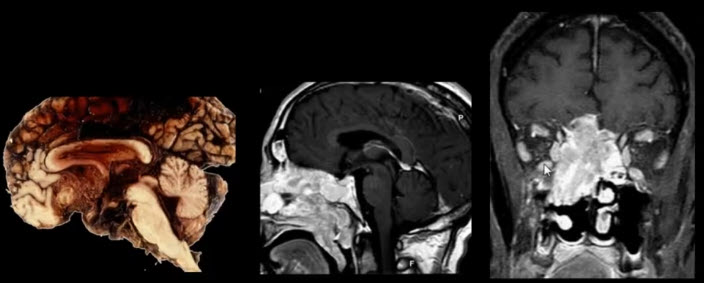
- Невринома обонятельного нерва
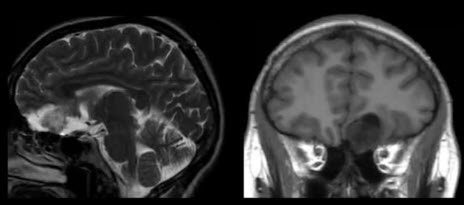
- Пациент, 60 лет, аносмия. МРТ. Менингиома площадки клиновидной кости и ольфакторной ямки
- Пациент, А., 52 г., аносмия МРТ. Невринома обонятельного нерва
- Зрительные нервы
- Астроцитома хиазмы
- Детский возраст (+/- нейрофиброматоз)
- Гетерогенное усиление
- Супраселлярная локализация
- +/- распространение на зрительные тракты
- Анапластическая астроцитома (нейрофиброматоз)
- Билатеральная глиома оптических путей
- Гамартоматозные поражения моста, ножек мозга, латеральных базальных ядер, зрительных бугров
- МТС по оболочкам (спустя 2 года)
- Рассеянный склероз
- III – глазодвигательный нерв. Блок срезов ориентирован по ходу цистернальной порции глазодвигательного нерва проекционно на ножки мозга (область межножковой цистерны)
- Изображение глазодвигательного нерва
- III – глазодвигательный нерв
- Нейроваскулярный конфликт
- Компрессия зоны входа правого блокового нерва (цистернальная порция) петлей верхней мозжечковой артерии
- Методика MPT тройничного нерва
- Блок срезов располагается в зоне входа корешка тройничного нерва в мост (по Т2-ВИ/Т1-ВИ в сагиттальной или Т2-ВИ в корональной плоскостях, ориентируясь на локализацию ствола тройничного нерва в боковых цистернах моста)
- Аксиальная плоскость
- Сагиттальная плоскость
- Корональная плоскость
- Гассеров узел
- V – тройничный нерв. Анатомо-топографические соотношения тройничного нерва и сосуда в норме
- V – тройничный нерв. Ростральный тип компрессии
- V – тройничный нерв. Латеральный тип компрессии
- Компрессия тройничного нерва основной артерией
- Тройничный нерв. ABM
- Тройничный нерв. Инфаркт продолговатого мозга (в месте расположения ядер V)
- Тройничный нерв. Кавернома
- Тройничный нерв. Рассеянный склероз
- Тройничный нерв. Менингит
- Тройничный нерв. Цитомегаловирусная инфекция
- Тройничный нерв. Саркоидоз
- Невринома тройничного нерва
- Наиболее часто ЧН У (полость Меккеля)
- Обычно хорошо очерчена
- Форма гантели с ЦП компонентом
- Обычно гиперинтенсивна на Т2-ВИ
- Одиночная/множественная (NF2)
- Одно/билатеральная локализация Т1-ВИ
- Меккелева полость
- Признак «подмигивающей» Меккелевой полости (один «глаз» закрыт): плотность/интенсивность не соответствует ликвору
- Патологические изменения дистальной части У ЧИ и иннервируемым им мышцам
- Острый процесс – гиперинтенсивность и +С мышцы
- Хронический – атрофия X и жировая дегенерация
- Невринома тройничного нерва
- Образование овальной формы, широким основанием прилежащее к твердой оболочке петрокливального региона, распространяющееся в задние отделы. Меккелевой полости, V нерв компремирован
- 3-D реконструкция выходных каналов I ветвей V ЧН
- Варианты расположения тригеминальных каналов и выходных отверстий
-
- Надглазничное отверстие(средняя треть глазницы – 83%)
- Одиночная надглазничная вырезка -60%
- Отверстие канала – 21% Множественные отверстия ипсилатеральной локализации – 17%
- Отсутствие надглазничного отверстия -1,5%
-
- Варианты расположения тригеминальных каналов и выходных отверстий
- Подглазничный канал (уровень скулочелюстного шва, лунка 5 зуба – 66%, длина – 10-15 мм)
- Два подглазничных отверстия -10%
- Форма – округлая, полуовальная, щелевидная
- Подглазничный канал (уровень скулочелюстного шва, лунка 5 зуба – 66%, длина – 10-15 мм)
- Варианты расположения тригеминальных каналов и выходных отверстии
- VI — отводящий нерв. Методика МРТ
- Блок срезов устанавливается в проекции нижней поверхности моста где корешки отводящего нерва располагаются в борозде между мостом и пирамидой
- Методика MPT VII и VIII
- Блок срезов устанавливается аксиально, каудальнее места расположения срезов при получении изображения тройничного нерва, ориентируясь на изображение внутреннего слухового прохода
- 1 – цистернальная часть лицевого нерва – 2,1 мм
- VIII — преддверно-улитковый нерв
- Преддверно-улитковый нерв (1) начинается от собственных ядер, расположенных в латеральной части ромбовидной ямки
- Показывается на нижней поверхности мозга кнаружи от оливы продолговатого мозга в виде двух корешков: вестибулярного (2) и улиткового (3)
- Поражение преддверно-улиткового нерва
- опухоли ММУ, сосудистые, демиелинизирующие или дегенеративные заболевания
- Поражение вестибулярного анализатора (внутреннего уха, вестибулярного нерва, ствола мозга):
- головокружение
- нистагм
- вестибулярная атаксия
- Поражение слухового анализатора:
- шум в ухе
- снижение слуха
- Анатомо-топографические соотношения ЗИМА и VII VIII ЧН в норме
- Компрессия лицевого нерва ПА
- Нейроваскулярный конфликт VII VIII ЧН
- Невринома
- Саркоидоз VII, карциноматоз VII, герпес VII
- Аплазия левого VIII
- Каудальная группа черепных нервов
- Блок срезов в аксиальной плоскости ориентирован параллельно преддверно-улитковым нервам, корональные срезы – вдоль оси продолговатого мозга
- IX языкоглоточный и X блуждающий нервы
- Компрессия языкоглоточного и блуждающего нервов ЗНМА
- Обширные патологические массы, компремирующие правые отделы ствола, распространяющиеся экстракраниально через яремное отверстие
- Компрессия IX нерва ЗНМА
- XI — добавочный нерв
- XII — подъязычный нерв
- Невринома каудальной группы нервов
Интернет-магазин медицинской литературы
Бесплатные лекции для врачей. Удобным списком