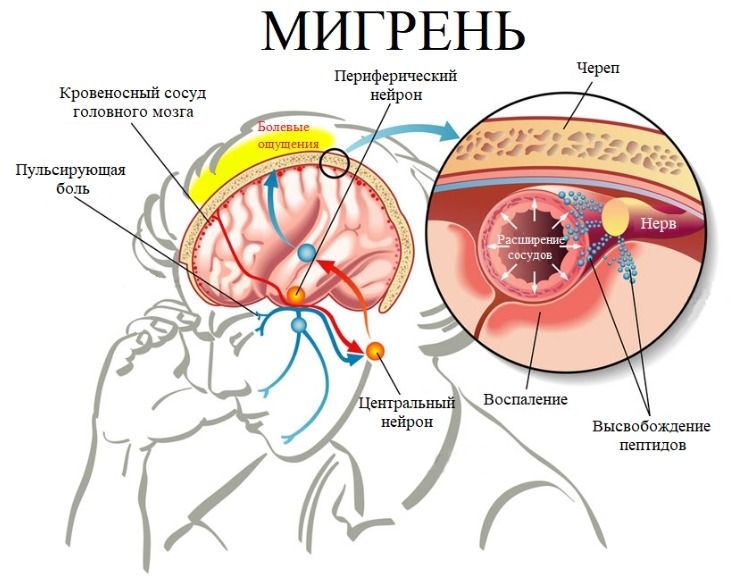
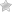Глядя в глаза человека, можно многое увидеть – глаза могут показать, правильно ли вы питаетесь и чем вы больны.
Если вы принимаете аспирин в течение длительного времени, существует повышенный риск дегенерации желтого пятна. В результате страдает определенная область сетчатки, после чего больной видит изображение искаженным.
Исследования, проведенные в Америке, показали, что у людей, которые принимали аспирин более десяти лет, вероятность развития болезни была значительно выше.
Симптомы ДЖП:
- прямые линии выглядят ломаными;
- сложно распознавать лица;
- посередине поля зрения образуется темное пятно;
- цвета теряют четкость;
- сложно читать — буквы искривлены и размыты;
- возникает необходимость подсветки;
- светочувствительность;
- слабое ночное зрение.
Другие факторы риска:
- Диабет, повышенное давление, гиперхолестеринемия, артериосклероз и др. сердечно-сосудистые проблемы;
- курение;
- ожирение;
- недостаточная подвижность;
- воздействие ультрафиолета.
Слишком много соли в пище может вызвать так называемую субкапиллярную катаракту. Это заболевание — одна из самых тяжелых форм катаракты.
Катаракта – это помутнение глазного хрусталика. Симптомы патологии:
- ухудшение зрения до слепоты;
- затемнение предметов;
- нечеткость предметов;
- нарушенное цветовосприятие;
- зрачок становится белым.
Другие факторы риска:
- воздействие ультрафиолета;
- неблагоприятная экология;
- курение, алкоголизм, наркомания;
- нарушение обмена веществ, диабет;
- наследственность;
- наличие глазных болезней;
- травмы глаз.
 Избыток соли приводит к субкапиллярной катаракте ” data-image-caption=”
Избыток соли приводит к субкапиллярной катаракте ” data-image-caption=”
Избыток соли приводит к субкапиллярной катаракте
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2021/07/izbytok-soli-privodit-k-subkapilljarnoj-katarakte-900×600.jpg” data-large-file=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1505_4peb3t5yitizbytok-soli-privodit-k-subkapilljarnoj-katarakte.jpg” loading=”lazy” class=”size-full wp-image-63227″ src=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1505_4peb3t5yitizbytok-soli-privodit-k-subkapilljarnoj-katarakte.jpg” alt=”Избыток соли приводит к субкапиллярной катаракте” srcset=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1505_4peb3t5yitizbytok-soli-privodit-k-subkapilljarnoj-katarakte.jpg 900w, https://unclinic.ru/wp-content/uploads/2021/07/izbytok-soli-privodit-k-subkapilljarnoj-katarakte-768×512.jpg 768w” sizes=”(max-width: 900px) 100vw, 900px” title=”Диагностика заболеваний по глазам”>
Женщины, принимающие противозачаточные таблетки, имеют более высокий риск развития глаукомы.
Исследования показали, что больший риск заболеть у пациенток, принимавших противозачаточные таблетки более трех лет подряд. Эти данные были получены в результате самооценки, а не официального опроса, поэтому к ним нельзя относиться со 100% доверием, но и игнорировать такие сведения нельзя.
Глаукома – одно из самых серьезных заболеваний глаз, связанное с повышением внутриглазного давления и атрофией зрительного нерва. Болезнь может привести к слепоте. Поэтому женщинам, принимающим противозачаточные таблетки, нужно регулярно, не реже одного раза в год, проходить осмотр глаз, а в случае ухудшения зрения немедленно обращаться к врачу.
Симптомы глаукомы:
- сужение поля зрения;
- снижение остроты зрения;
- резь, боль, тяжесть в больном глазу;
- туман перед глазами;
- при взгляде на свет образуются цветные пятна;
- слепота в сумерках;
- повышенная влажность глаз;
- гиперемия глазного яблока.
Другие факторы риска:
- порог возраста 70 лет;
- дальнозоркость;
- высокое ВГД;
- гипотензия;
- диабет;
- нарушения работы гормональной и нервной систем;
- патологии сосудов;
- травмы, воспаления глаз;
- наследственность.
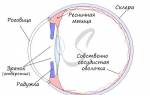
Если вы когда-нибудь видели предметы сквозь туман и это сопровождалось сильной головной болью — у вас был приступ мигрени. Это нарушение зрения – один из первых признаков мигрени.
Триггеры приступов мигрени:
- колебания гормонов;
- стресс;
- нарушения сна;
- перемена погоды;
- алкоголь;
- яркий свет;
- красное вино, пиво, черный шоколад, твердый сыр, орехи, цитрусовые, консерванты;
- голодание.
 Что такое мигрень ” data-image-caption=”
Что такое мигрень ” data-image-caption=”
Что такое мигрень
” data-medium-file=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1506_obws4hf6vtchto-takoe-migren.jpg” data-large-file=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1506_obws4hf6vtchto-takoe-migren.jpg” loading=”lazy” class=”size-full wp-image-52476″ src=”https://argus-eyeclinic.ru/info/wp-content/uploads/2023/01/pp_image_1506_obws4hf6vtchto-takoe-migren.jpg” alt=”Что такое мигрень” title=”Диагностика заболеваний по глазам”>
Пучеглазие — один из признаков сверхактивной щитовидной железы — гипертиреоза. При активации щитовидной железы в тканях глазницы начинают накапливаться определенные белки, за счет чего глазное яблоко немного выдвигается вперед. Это не истинное пучеглазие.
Гормоны щитовидной железы контролируют многие обменные процессы в организме. К симптомам этого заболевания также относятся:
- учащенное сердцебиение;
- высокое кровяное давление;
- тремор;
- потливость;
- повышенная светочувствительность;
- двоение зрения.
Обычно поражаются оба глаза.
Истинное пучеглазие вызывают:
- Флегмона глазницы. Поражается один глаз. Отмечаются: боль при движении и вокруг глаз, краснота и отек век, ограничение движения глазами.
- Опухоль в глазной впадине. Ухудшается зрение, глаз болит, больного беспокоит головная боль, двоение предметов.
- Ретробульбарное кровоизлияние в глазнице. Поражается один глаз. Резко появляются двоение зрения, боли.
Если у вас желтые глазные яблоки, скорее всего, у вас желтуха. В первую очередь желтеет небо, затем желтеют яблоки глаз и, наконец, кожа.
Другие причины пожелтения глаз:
- острый панкреатит;
- рак печени, желчного пузыря и протоков, поджелудочной железы;
- гемолитическая анемия;
- малярия;
- заболевания крови, влияющие на эритроциты;
- генетические заболевания печени;
- вирусы гепатита;
- камни в желчном пузыре;
- цирроз;
- прием ацетаминофена, пенициллина, оральных контрацептивов, хлорпромазина, анаболиков.
Желтуха – почему желтеет кожа и глаза
” data-image-caption=”” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/06/zheltuha-pochemu-zhelteet-kozha-i-glaza-900×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/06/zheltuha-pochemu-zhelteet-kozha-i-glaza.jpg” loading=”lazy” class=”aligncenter size-full wp-image-49686″ src=”https://unclinic.ru/wp-content/uploads/2020/06/zheltuha-pochemu-zhelteet-kozha-i-glaza.jpg” alt=”Желтуха – почему желтеет кожа и глаза” srcset=”https://unclinic.ru/wp-content/uploads/2020/06/zheltuha-pochemu-zhelteet-kozha-i-glaza.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/06/zheltuha-pochemu-zhelteet-kozha-i-glaza-768×512.jpg 768w” sizes=”(max-width: 900px) 100vw, 900px” title=”Диагностика заболеваний по глазам”>
Слезливые, красные, болезненные глаза могут быть признаком аллергии. Эти симптомы беспокоят многих людей с сенной лихорадкой, но болезнь хорошо контролируется с помощью лекарств.
Если у вас слезятся глаза, при этом по утрам беспокоят густые выделения, глаза болят и чувствительны к свету, веки слипаются – у вас глазная инфекция. В этом случае следует немедленно обратиться к врачу.
У людей с этим заболеванием больше шансов потерять зрение, чем у людей, не страдающих диабетом. Вероятность развития глаукомы у людей с диабетом составляет 40%. выше, а катаракты — на 60%. выше, чем у здоровых людей. С этим заболеванием, без контроля над диабетом, высок риск разрушения кровеносных сосудов.
Беловатое кольцо вокруг радужки – признак атеросклероза. Если вы видите лишнее внешнее черное кольцо вокруг беловатого (мутного) кольца, это ранний атеросклероз.
Возрастная дуга – это помутнение роговицы, связанное с нарушением липидного обмена. Патология свойственна пожилым пациентам. Помутнение вызвано отложением липидов в роговице. В начале заболевания в нижних слоях образуется серовато-желтая дуга. Затем она разрастается, замыкаясь в кольцо.
По наследству могут передаваться различные заболевания, многие из которых являются достаточно опасными. Поэтому люди, решившие на ЭКО, проходят обследование ПГД эмбриона. Оно проводится то переноса его в полость матки, позволяет определить, какими заболеваниями может заболеть ребенок после рождения. Данная процедура является достаточно ответственной и важной. Ее должны проводить профильные специалисты с огромным опытом работы.
Что нужно знать?
Существует целый ряд наследственных заболеваний. Среди них стоит выделить:
- Близорукость. Недуг дает о себе знать в подростковом возрасте, при этом ребенок плохо видит те предметы, которые находятся вдали от него. При этом если родители имеют хорошее зрение, то риск патологий у детей составляет всего 10%.
- Синдром Дауна. Это достаточно опасное заболевание, при котором человек не может полноценно находится в обществе, имеет ограниченные возможности здоровья. Риск рождения ребенка с синдромом Дауна увеличивается от возраста матери.
- Дальтонизм. Это заболевание носит наследственный характер, оно выражается в неспособности человека различать цвета (одного или нескольких). Данной патологией страдают в основном представители сильного пола.
- Синдром Клайнфельтера. Он характерный для мужчин, проявляется в основном в период полового созревания. Данный недуг приводит к бесплодию. Пациенты имеют увеличенную грудную железу.
- Гемофелия. Это заболевания сыны могут унаследовать от матери. Оно характеризуется нарушениями свертывания крови, является достаточно опасным. Пациент с таким недугом постоянно привязан к медикаментам.
- Муковисцидоз. Является наследственным заболеванием, при котором люди страдают повышенным потоотделением, имеют серьезные проблемы с легкими.
- Мигрень. Данный недуг был опии сан еще в древних папирусах. Он сопровождается сильными головными болями, которые локализуются в одной части полушария.
Сегодня многие люди часто задумываются о том, стоит ли делать ПГД. Ответ на него зависит от многих факторов. Не стоит забывать о том, что данное исследование поможет избежать опасных последствий в будущем.
Генами называются участки ДНК, в которых закодирована структура всех белков в теле человека или любого другого живого организма. В биологии действует правило: «один ген – один белок», то есть в каждом гене содержится информация только об одном определенном белке.
В 1990 году большая группа ученых из разных стран начала проект под названием «Геном человека». Он завершился в 2003 году и помог установить, что человеческий геном содержит 20–25 тысяч генов. Каждый ген представлен двумя копиями, которые кодируют один и тот же белок, но могут немного различаться. Большинство генов одинаковые у всех людей – различается всего 1%.
ДНК находится в клетке внутри ядра. Она особым образом организована в виде хромосом – эти нитеподобные структуры можно рассмотреть в микроскоп с достаточно большим увеличением. Внутри хромосомы ДНК намотана на белки – гистоны. Когда гены неактивны, они расположены очень компактно, а во время считывания генетического материала молекула ДНК расплетается.
В клетках человека есть структуры, которые называются митохондриями. Они выполняют роль «электростанций» и отвечают за дыхание. Это единственные клеточные органеллы, у которых есть собственная ДНК. И в ней тоже могут возникать нарушения. Весь набор хромосом в клетке называется кариотипом. В норме у человека он представлен 23 парами хромосом, всего их 46. Выделяют два вида хромосом:
- 22 пары аутосом одинаковы у мужчин и женщин. В каждой паре хромосомы имеют одинаковую длину и содержат одинаковые наборы генов.
- Одна пара половых хромосом. У женщин это две X-хромосомы. Одна из них неактивна и плотно свернута – ее называют тельцем Барра. У мужчин одна половая хромосома представлена X-хромосомой, а вторая – Y-хромосомой, она меньше по размерам.
Методы исследования хромосом
Для исследования кариотипа применяют специальный метод – световую микроскопию дифференциально окрашенных метафазных хромосом культивированных лимфоцитов периферической крови.
Этот анализ применяется для диагностики различных хромосомных заболеваний. Он позволяет выявлять такие нарушения, как:
- Грубые изменения в кариотипе – изменение количества хромосом. Например, при синдроме Дауна в клетках ребенка присутствует лишняя хромосома №21.
- Присутствие в организме клеток с разными кариотипами. Это явление называется мозаицизмом.
- Хромосомные аберрации – нарушение структуры хромосом, внутрихромосомные и межхромосомные перестройки. Сюда относятся делеции (утрата участка хромосомы), дупликации (удвоение участка хромосомы), инверсии (поворот участка хромосомы на 180 градусов), транслокации (перенос участка одной хромосомы в другую).
Однако с помощью исследования кариотипа можно выявить не все генетические нарушения. Оно не способно обнаружить такие изменения, как:
- микроделеции и микродупликации, когда утрачивается или дублируется очень маленький участок хромосомы;
- болезни обмена, вызванные нарушением последовательности «букв» генетического кода в отдельных генах;
- митохондриальные заболевания, связанные с нарушениями в генетическом материале митохондрий;
- низкопроцентный мозаицизм, когда клеток с неправильным кариотипом очень мало;
- мутации в отдельных генах, которые не приводят к изменению внешнего вида хромосом;
- эпигенетические расстройства, при которых структура хромосом и генов не меняется, но изменяется их функция.
Для получения дополнительной информации, не видимой в световой микроскоп, используют хромосомный микроматричный анализ (ХМА). С его помощью можно изучить все клинически значимые участки генома и выявить изменения в количестве и структуре хромосом, а именно микрополомки (микроделеции и микродупликации).
Во время хромосомного микроматричного анализа применяют технологию полногеномной амплификации и гибридизации фрагментов опытной ДНК с олигонуклеотидами, нанесенными на микроматрицу. Если объяснять простыми словами, то сначала ДНК, которую необходимо изучить, копируют, чтобы увеличить ее количество, а затем смешивают ее со специальными ДНК-микрочипами, которые помогают выявлять различные нарушения.
Эта методика позволяет в одном исследовании выявлять делеции и дупликации участков ДНК по всему геному. Разрешающая способность стандартного ХМА от 100 000 пар нуклеотидов – «букв» генетического кода (в отдельных регионах от 10 000 п. н.).
С помощью ХМА можно выявлять:
- изменения числа хромосом;
- дупликации и делеции, в том числе микродупликации и микроделеции;
- отсутствие гетерозиготности – утрату одной из двух копий гена. Это явление имеет важное значение в онкологии, при болезнях импринтинга (когда активность гена зависит от того, от какого из родителей он получен), аутосомно-рецессивных заболеваниях (связанных с рецессивными генами – о них мы поговорим ниже), близкородственных браках;
- однородительские дисомии, когда в геноме ребенка присутствуют две хромосомы от одного родителя.
Однако, как и предыдущий метод, хромосомный микроматричный анализ имеет некоторые ограничения. Он не позволяет выявлять или ограничен в выявлении таких аномалий, как:
- сбалансированные хромосомные аномалии, когда в хромосомах происходят изменения, которые не приводят к добавлению или утрате генетического материала. К ним относятся инверсии (разворот участка хромосомы на 180 градусов), реципрокные транслокации (обмен участками между хромосомами), небольшие инсерции (вставки в хромосомах);
- мозаицизм, если клеток с нарушениями в кариотипе менее 15%;
- CNV (copy number variation) – повторы небольших участков генома;
- точечные мутации – замены отдельных «букв» генетического кода;
- экспансия (увеличение) повторов коротких участков в ДНК;
- аномалии метилирования – присоединения особых метильных групп к определенным участкам ДНК, которые меняют активность генов.
Мутации в генах и заболевания, к которым они способны приводить Мутации – это изменения, которые происходят в ДНК как случайным образом, так и под действием разных факторов, например химических веществ, ионизирующих излучений. Они могут затрагивать как отдельные «буквы» генетического кода, так и большие участки генома. Мутации происходят постоянно, и это основной двигатель эволюции. Чаще всего они бывают нейтральными, то есть ни на что не влияют, не приносят ни вреда, ни пользы. В редких случаях встречаются полезные мутации – они дают организму некоторые преимущества. Также встречаются вредные мутации – из-за них нарушается работа важных белков, наоборот, происходят достаточно часто. Генетические изменения, которые происходят более чем у 1% людей, называются полиморфизмами – это нормальная, естественная изменчивость ДНК Полиморфизмы ответственны за множество нормальных отличий между людьми, таких как цвет глаз, волос и группа крови. Все внешние признаки и особенности работы организма, которые человек получает от родителей, передаются с помощью генов. Это важнейшее свойство всех живых организмов называется наследственностью. В зависимости от того, как проявляются гены в тех или иных признаках, их делят на две большие группы. Доминантные гены. Выражаясь простым языком, эти гены более «сильные». Если в клетках присутствует хотя бы одна копия такого гена, его признаки проявятся. Рецессивные гены «слабее» доминантных. Если у человека одна копия гена доминантная и одна рецессивная, – проявится признак доминантной. А для проявления рецессивного признака нужно две соответствующих копий. Например, карий цвет глаз у человека является доминантным. Поэтому у кареглазых родителей с высокой вероятностью родится кареглазый ребенок. Если у одного из родителей глаза карие, а у другого голубые, то вероятность рождения кареглазых детей в такой семье тоже высока. У двух голубоглазых родителей, скорее всего, все дети тоже будут голубоглазыми. А вот у кареглазых родителей может родиться ребенок с голубыми глазами, если у обоих есть рецессивные «гены голубоглазости», и они достанутся ребенку. Конечно, это упрощенная схема, потому что за цвет глаз отвечает не один, а несколько генов, но на практике эти законы наследования зачастую работают. Аналогичным образом потомству могут передаваться и наследственные заболевания. Как выявляют рецессивные мутации?
Для выявления мутаций, которые передаются рецессивно, используют целый ряд исследований.
Секвенирование по Сэнгеру – метод секвенирования (определения последовательности нуклеотидов, буквально – «прочтение» генетического кода) ДНК, также известен как метод обрыва цепи. Анализ используется для подтверждения выявленных мутаций. Это лучший метод для идентификации коротких тандемных повторов и секвенирования отдельных генов. Метод может обрабатывать только относительно короткие последовательности ДНК (до 300–1000 пар оснований) одновременно. Однако самым большим недостатком этого метода является большое количество времени, которое требуется для его проведения.
Если неизвестно, какую нужно выявить мутацию, то используют специальные панели.
Панель исследования — тестирование на наличие определенных мутаций, входящих в перечень конкретной панели исследования. Анализ позволяет выявить одномоментно разные мутации, которые могут приводить к генетическим заболеваниям. Анализ позволяет компоновать мутации в панели по частоте встречаемости (скрининговые панели, направленные на выявление носительства патологической мутации, часто встречаемой в данном регионе или в определенной замкнутой популяции) и по поражаемому органу или системе органов (панель «Патология соединительной ткани»). Но и у этого анализа есть ограничения. Анализ не позволяет выявить хромосомные аберрации, мозаицизм и мутации, не включенные в панель, митохондриальные заболевания, а также эпигенетические нарушения.
Не в каждой семье можно отследить все возможные рецессивные заболевания. Тогда на помощь приходит секвенирование экзома – тест для определения генетических повреждений (мутаций) в ДНК путем исследования в одном тесте практически всех областей генома, кодирующих белки, изменения которых являются причиной наследственных болезней.
Секвенирование следующего поколения-NGS – определение последовательности нуклеотидов в геномной ДНК или в совокупности информационных РНК (транскриптоме) путем амплификации (копирования) множества коротких участков генов. Это разнообразие генных фрагментов в итоге покрывает всю совокупность целевых генов или, при необходимости, весь геном.
Анализ позволяет выявить точечные мутации, вставки, делеции, инверсии и перестановки в экзоме. Анализ не позволяет выявить большие перестройки; мутации с изменением числа копий (CNV); мутации, вовлеченные в трехаллельное наследование; мутации митохондриального генома; эпигенетические эффекты; большие тринуклеотидные повторы; рецессивные мутации, связанные с Х-хромосомой, у женщин при заболеваниях, связанных с неравномерной Х-деактивацией, фенокопии и однородительские дисомии, и гены, имеющие близкие по структуре псевдогены, могут не распознаваться.
Что делать, если в семье есть наследственное заболевание?
Существуют два способа выявить наследственные генетические мутации у эмбриона:
Предимплантационное генетическое тестирование (ПГТ) в цикле ЭКО. Это диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера (клетки зародыша) у эмбриона на стадии дробления (4–10 бластомеров). Существует несколько видов ПГТ: на хромосомные отклонения, на моногенные заболевания и на структурные хромосомные перестройки. Данные Simon с соавторами (2018) говорят о том, что в случае проведения ЭКО с ПГТ у пациентки 38–40 лет результативность ЭКО составляет 60%. Но при исследовании эмбриона есть ряд ограничений. Так, из-за ограниченного числа клеток можно не определить мозаицизм.
Если нет возможности провести ЭКО с ПГТ, то используют второй вариант – исследование плодного материала во время беременности.
Для забора плодного материала используют инвазивные методы:
- биопсия хориона – когда берут клетки из плаценты;
- амниоцентез – когда берут клетки амниотической жидкости.
Далее эти клетки исследуют при помощи одного или нескольких генетических тестов (которые имеют свои ограничения). Проведение инвазивных методов может быть связано с риском для беременности порядка 1%.
Таким образом, проведя дополнительные исследования, можно значительно снизить риск рождения ребенка с генетическим заболеванием в конкретной семье. Но привести этот риск к нулю на сегодняшний день, к сожалению, невозможно, так как любой генетический тест имеет ряд ограничений, что делает невозможным исключить абсолютно все генетические болезни.
Автор статьи
Пелина Ангелина Георгиевна
Врач-генетик
Ведёт генетическое обследование доноров Репробанка, осуществляет подбор доноров для пар, имеющих ранее рождённых детей с установленной генетической патологией.
+7 (499) 653-66-09
info@reprobank.ru
Записаться на консультацию
К нейродегенеративным заболеваниям относится целая группа болезней, в основе которых лежат процессы, разрушающие клетки мозга. Болезни могут отличаться симптоматикой, продолжительностью, очагом поражения, но всех их объединяет деменция (слабоумие, разрушение личности), которая является неизменным спутником всех нейродегенеративных заболеваний головного мозга.
Все заболевания, входящие в эту группу, приводят к полной деградации личности, деменции в результате гибели клеток мозга. Этот процесс является необратимым, и главной задачей стоящей перед врачом является приостановление процесса. Деменция проявляется при каждом отдельном заболевании по-разному, в разной степени и на различных этапах, но итог, как правило, один и тот же – деградация личности и смерть от соматических заболеваний.
Все нейродегенеративные заболевания головного мозга проявляются в различном возрасте и не являются признаком глубокой старости.
Перечислим некоторые, наиболее распространенные заболевания данного типа: Болезнь Альцгеймера. Эта болезнь известна в народе как «старческий маразм». Однако эта болезнь не является старческой, она может развиваться и в 40 лет, и даже раньше. Начальная стадия часто слабо выражена, поэтому начало болезни можно упустить. Со временем проблемы с памятью усиливаются, страдает мышление и восприятие, речь, а также могут страдать зрение и слух.
Болезнь Паркинсона. Эта болезнь известна тем, что заболевший страдает сильным тремором, у него трясутся руки и голова, он не может нормально передвигаться и держать предметы. Чаще всего это заболевание встречается у пожилых людей старше 60 лет. Помимо движений страдает речь, жевательные мышцы ослабевают, наблюдается слюнотечение.
Болезнь Пика. Также чаще встречается у людей в возрасте. Некоторые участки мозга атрофируются, что приводит к деменции и различным нарушениям. Для этого заболевания характерны признаки деменции уже на самых ранних стадиях. Болезнь быстро прогрессирует. Средняя продолжительность жизни при болезни Пика 6 лет.
Деменция с тельцами Леви. Тельцами Леви называют специфический белок, который накапливается в клетках мозга, вызывая их гибель. Симптомы схожи с болезнью Паркинсона. Болезнь прогрессирует, однако сопровождается редкими улучшениями. В рамках каждого отдельного заболевания могу различаться различные стадии, степени, формы деменции, локализация очагов поражения мозга.
Неизменными симптомами нейродегенеративных заболеваний головного мозга являются признаки деменции. Именно они подают сигнал о каких-то патологических процессах в мозге. Сначала у человека нарушается память, он забывает имена, путает даты, не может вспомнить, куда положил кошелек и гулял ли с собакой, однако критика и сознание еще в норме. На этом этапе можно принять деменцию на обычную рассеянность, которая свойственна многим людям и не только в пожилом возрасте. Со временем у больного начинает снижаться интеллект, нарушается пространственная ориентация, привычные навыки теряются, человек с трудом пользуется бытовыми приборами, при этом не признается в своей несамостоятельности, то есть критика ослабевает.
Последней стадией деменции является полный распад личности. Для семьи пациент видится совершенно безумным человеком, который никого не узнает. Любое общение с больным становится практически невозможным. Человек нуждается в постоянном уходе, наблюдении. Затем в результате соматических заболеваний наступает смерть. Причинами возникновения нейродегенеративных заболеваний могут служить различные процессы и факторы. Они далеко не всегда зависят от наследственности или травм.
Ключевые причины нейродегенеративных заболеваний:
Сосудистые заболевания. Проблемы с сосудами могут приводить к недостаточному питанию головного мозга. При серьезных сосудистых заболеваниях клетки мозга начинают постепенно гибнуть. Однако этот процесс в некоторых случаях можно остановить, если лечить первопричину.
Генетическая предрасположенность. Некоторое болезни имеют свой ген, например, есть тест, показывающий предрасположенность к болезни Альцгеймера, его предлагают пройти тем, у кого есть родственники с данным заболеванием.
Черепно-мозговые травмы. В результате травматизации мозгового вещества , одно из возможных последствий – деменция.
Рак головного мозга. Опухоли могут образовываться в различных долях и участках мозга, но все они сопровождаются неврологическими изменениями, включая слепоту, глухоту, расстройства памяти и мышления, деградацию личности.
Инфекции. Различные серьезные инфекции типа энцефалита, сифилиса, ВИЧ так же иногда приводят к разрушению клеток мозга.
Диагностика Способы исследований нейродегенеративных заболеваний головного мозга Диагностика нейродегенеративных заболеваний головного мозга осложняется тем, что не существует такого анализа или обследования, которое бы точно и быстро указало на конкретный диагноз. Конечно, диагностика может включать в себя и анализ крови, и МРТ, и электроэнцефалограмму. Особенно это касается черепно-мозговых травм.
МРТ показывает, есть ли опухоли в мозге, есть ли проблемы с сосудами, кровоизлияния и какие-либо изменения.
Анализ крови помогает узнать, если ли анемия, произошли ли какие-либо изменения с клетками крови.
Если человек заподозрил у себя или своего члена семьи признаки деменции, он должен пройти обследование у невролога, терапевта и окулиста, а также посетить психиатра. Очень часто начало нейродегенеративного заболевания можно спутать с сильной депрессией, когда также ухудшается память, начинаются проблемы с общением, восприятием, человек затрудняется в подборе слов. Такая сильная депрессия может развиться после шока, травмы или стресса. Чтобы поставить диагноз, помимо сдачи всех анализов, необходимо наблюдение пациента в течение полугода. Если в течение этого времени те же самые симптомы будут наблюдаться или же усугубляться, можно говорить о деменции.
Признаками нейродегенеративного заболевания являются также нарушение слуха, иногда галлюцинации и бред, наличие органического поражения мозга (кровоизлияние, опухоль). Во время обследования пациент проходит несколько тестов на восприятие, память, логическое и абстрактное мышление. Например, врач просит больного запомнить 3 слова, несвязанных друг с другом по смыслу, например, «стул, небо, злость». Затем просят нарисовать циферблат часов и написать рядом цифры. Через некоторое время пациент должен повторить слова. Эти тесты могут проводиться с определенной периодичностью в течение нескольких месяцев, чтобы увидеть скорость прогрессирования заболевания.
Так же в качестве диагностики применяется люмбальная пункция. Через небольшой прокол в пояснице у больного берут некоторое количество спинномозговой жидкости. Ее используют для обследования и дальнейшей диагностики состояния организма, а также таким образом снижают внутричерепное давление. Подобное исследование поможет выявить наличие серьезных инфекций, кровоизлияний в головном мозге, различные опухоли.
Лечение . Лечение нейродегенеративных заболеваний имеет свои особенности: Одновременно необходимо лечить и соматические заболевания. Больные требуют постоянно ухода и поддержки. Их не рекомендуется оставлять в одиночестве и изолировать от общества, поскольку это лишь усугубит течение болезни. Социальная поддержка и психологическая помощь являются незаменимой частью комплексного лечения. Медикаментозное лечение зависит от конкретного заболевания и причины ее возникновения. Например, при сосудистой деменции обязательно назначаются препараты для укрепления сосудов и нормализации кровяного давления. Также при нейродегенеративных заболеваниях прописывают ноотропы (для улучшения питания головного мозга) и нейролептики (успокаивающие препараты). Депрессия часто сопровождает деменцию. При болезни Паркинсона на определенном этапе возникает склонность к суициду. По этой причине при нейродегенеративных заболеваниях назначают антидепрессанты. Однако эти препараты имеют множество побочных эффектов. Их подбирают и корректируют по ходу лечения. На начальных стадиях важно поддерживать определенную умственную нагрузку. Пациенты выполняют различные упражнения для тренировки памяти и мышления. Это помогает замедлить течение болезни. Важно следить за питанием больного. Нейродегенеративные заболевания сопровождаются различными расстройствами пищеварительной и выделительной системы, у пациентов ухудшается аппетит, может развиться булимия. Если это лежачий больной, его необходимо кормить по времени, исключая продукты, которые могут спровоцировать непроходимость кишечника.
Застраховать себя от нейродегенеративных заболеваний невозможно, но можно снизить риск их возникновения или замедлить развитие: Изучать иностранные языки. Это звучит странно, но полиглоты реже страдают нейродегенеративными заболеваниями, или же они проявляются позже. Как можно дольше поддерживать уровень физической и умственной активности. При гиподинамии возникают проблемы с сосудами, которые могут ухудшить питание мозга и привести к деменции. Интеллектуальная деятельность также важна. Доказано, что образованные люди с высоким интеллектом, если и страдают нейродегенеративными заболеваниями, то они начинают проявляться позже, поскольку функции погибших клеток мозга передаются другим клеткам. Бороться с заболеваниями, приводящими к деменции. К факторам риска можно отнести сахарный диабет, ожирение, алкоголизм. Все эти состояния необходимо лечить и наблюдать, чтобы снизить риск возникновения нейродегенеративных заболеваний. При таком количестве симптомов нейродегенеративные заболевания могут осложняться уже на начальных этапах различными состояниями и нарушениями. Например, бессонница. Она мучает не всех и не на каждом этапе, но иногда люди с прогрессирующей деменцией не могут нормально спать вообще или спят днем, а ночью бродят. Одним из осложнений является агрессия. Некоторые пациенты могут проявлять агрессию, воспринимая врачей и членов семьи как угрозу. Галлюцинации также провоцируют агрессию. Чаще это можно наблюдать при болезни Пика и алкогольной деменции. Галлюцинации являются серьезным осложнениям, приносящим много проблем и больному, и членам его семьи. Галлюцинации в отличии от иллюзии возникают без каких-либо внешних воздействий. Пациент видит то, чего нет, и воспринимает это как реальность. Галлюцинации могут быть очень пугающими, больной кричит и испытывает сильнейший стресс. Это осложнение встречается при деменции с тельцами Леви. На начальных стадиях развития болезни она может осложниться депрессией, когда человек понимает, что болен и к чему это в результате приведет.
Международная группа ученых при участии российских специалистов выявила ген, мутации в котором объясняют наследственную слепоту. Речь о причинах возникновения наследственной оптической нейропатии Лебера — редкого заболевания, которое приводит к полной потере зрения. До последнего времени генетические причины его возникновения в 24% случаев оставались не до конца ясны. Ученые выяснили, что нарушение зрения может развиваться из-за мутации в гене DNAJC30. Исследования показали, что среди жителей России носителей этого мутантного гена больше, чем в других странах. Но знание причин позволит точнее диагностировать заболевание, а в будущем создать от него лекарство.
Неправильный ген
Международная группа биохимиков, генетиков и офтальмологов из 34 научных организаций завершила исследование по изучению механизмов возникновения наследственной оптической нейропатии Лебера. В работе в том числе приняли участие специалисты Медико-генетического научного центра имени академика Н.П. Бочкова. Об этом «Известиям» рассказали в Министерстве науки и высшего образования РФ.
Нейропатия Лебера встречается с частотой один случай на 30 тыс. человек и приводит к потере центрального зрения на обоих глазах.
В поле зрения  Фото: ИЗВЕСТИЯ/Александр Казаков
Фото: ИЗВЕСТИЯ/Александр Казаков 
Ученые выяснили, что в некоторых случаях причина развития болезни — мутации в гене DNAJC30. Ранее роль этого гена оставалась неизвестной. Оказалось, что его продукт — белок DNAJC30 — выполняет функцию шаперона в дыхательной цепи митохондрий, то есть помогает пространственной конфигурации полипептидной цепи. Отсутствие белка DNAJC30 из-за мутации гена приводит к тому, что в митохондриях накапливаются нефункциональные белки. Это нарушает дыхательную цепь митохондрий клеток, что приводит к развитию клинической картины заболевания.
— Представьте ботинок со шнурками. Именно на него внешне похож один из главных белковых комплексов в митохондриях. Шнурки изнашиваются, и их нужно вовремя менять. Белок DNAJC30 ответственен за своевременную смену «шнурков» в митохондриальном «ботинке». Это нужно, чтобы митохондрии вновь были свежими и полными энергии, — пояснила старший научный сотрудник лаборатории наследственных болезней обмена веществ ФГБНУ «МГНЦ имени академика Н.П. Бочкова» Полина Цыганкова.
Во время исследования ученые провели секвенирование (расшифровку) экзома пациентов с неподтвержденным диагнозом. Экзом — набор всех генов, кодирующих белки. В выборку попали 33 пациента с клиническими проявлениями нейропатии Лебера, из которых 16 было выявлено в России.
Описанная мутация гена DNAJC30 характерна для восточноевропейских популяций, которая предположительно образовалась 85 поколений назад. Исследования показали, что среди населения России носителей DNAJC30 больше, чем в других странах. Мутация наследуется по аутосомно-рецессивному типу, то есть родители пациентов остаются ее здоровыми носителями, а ребенок, получивший по одной поврежденной копии гена от каждого из них, заболевает. Средний возраст начала болезни — 28 лет. У мужчин она проявляется в пять раз чаще, чем у женщин.
Первый шаг
Изучение природы заболевания позволяет понять и прогнозировать возможности его лечения с помощью генной терапии, пояснил заместитель генерального директора по научной работе Национального медицинского исследовательского центра МНТК микрохирургии глаза имени академика С.Н. Федорова, председатель Общества офтальмологов России Борис Малюгин.
— Идентифицируя ген, мы делаем первый шаг на этом долгом пути, — пояснил он.
У части пациентов не отмечалось изменений в митохондриальной ДНК, которые есть у большинства больных. При этом фенотипически проявлялись все признаки заболевания. Теперь ученые нашли причину, которая заключалась в мутациях в гене DNAJC30, отметил специалист.
В поле зрения  Фото: Depositphotos
Фото: Depositphotos 
— Так как этот вариант заболевания является моногенным, то есть вызван потерей функциональности одного белка из-за мутаций в соответствующем гене, то заболевание будет подходить для терапии на основе адено-ассоциированных вирусов. Она позволяет доставить исправленную копию «недостающего» гена и вернуть его функциональность, — рассказал сотрудник лаборатории геномной инженерии МФТИ (вуз — участник проекта повышения конкурентоспособности образования «5-100») Евгений Кегелес.
По словам эксперта, этот подход — основной метод генной терапии, он показывает многообещающие результаты не только в испытаниях, но и в клиниках. Например, препарат Luxturna используется для лечения врожденного амавроза Лебера, рассказал специалист.
Результаты исследования уже сейчас могут использовать врачи-генетики, консультирующие пары, в чьих семьях встречается нейропатия Лебера, отметила заведующая кафедрой биологии и общей генетики РУДН Мадина Азова.
— При генотипировании нужно исследовать на наличие мутаций не только митохондриальную ДНК, но и ген DNAJC30, — считает она.
Стоит продолжить работы по секвенированию генома при подозрении на распространенные патологии глаза, имеющие генетическую основу, отметил заведующий Центром офтальмологии Пироговского центра Ринат Файзрахманов.
Читайте также