Содержание
- Что такое врожденный амавроз Лебера и как проявляется это заболевание?
- Как наука узнала, что потеря зрения передается по наследству?
- Врожденный амавроз Лебера — это группа заболеваний?
- Как ошибки в гене влияют на зрение?
- Можно ли вылечить врожденную слепоту?
- Как работает первый и единственный препарат против поломки гена, ответственного за слепоту?
- Всем ли подойдет генная терапия?
- История создания зрительного протеза
- Первые ретинальные импланты
- Тренды ретинальных имплантов: основные фундаментальные технологии
- Российский опыт ретинального протезирования
- Кортикальные системы имплантации
- Почему от ковида можно ослепнуть
- Как люди теряют зрение за пару часов
- Как ковид вызывает глазное кровоизлияние
- Почему человек может ослепнуть и через полгода после ковида
- Как часто ковид приводит к потере зрения
- Опасен ли для глаз “омикрон”?
- Симптомы ухудшения зрения из-за сосудов: “раздавленный помидор” и “вишнёвая косточка”
- Как врачи пытаются вернуть зрение пациенту
- Будет ли снова видеть человек?
- Когда идти к офтальмологу

Что такое врожденный амавроз Лебера и как проявляется это заболевание?
Врожденный амавроз Лебера — это тяжелое наследственное заболевание сетчатки, которое приводит к сильному ухудшению зрения и слепоте. Оно встречается у одного человека из 33 тысяч во всем мире. Уже на первом году жизни ребенка родители замечают, что младенец не фиксирует взгляд, а его зрачок не реагирует на свет. Среди других симптомов — неконтролируемые ритмичные движения глазных яблок (нистагм), постоянное надавливание на глаза и трение глаз костяшками пальцев (симптом Франческетти).
Полная потеря зрения, как правило, наступает к 10 годам или подростковому возрасту.
Врожденный амавроз или слепота (от греческого слова amauros — «темный, слепой») Лебера — это генетическое заболевание, то есть его причина — неправильная работа генов. Оно составляет более 5% от всех унаследованных заболеваний сетчатки: известно, что с ним родились около 20% слепых детей, обучающихся в специализированных образовательных учреждениях.
Как наука узнала, что потеря зрения передается по наследству?
В 1869 году немецкий офтальмолог Теодор Лебер впервые выявил необычную и тяжелую форму потери зрения у ребенка. Чуть позже, наблюдая за детьми в школе для незрячих, он заметил, что заболевание имеет «кровное родство» — так появилась его статья, в которой врач рассуждал о том, что слепота передается по наследству. Предположения Лебера впоследствии подтвердились, а описанные им случаи атрофии зрительных нервов разошлись на два самостоятельных заболевания — с разными генетическими причинами возникновения, типом наследования, клиническими проявлениями и методами лечения. Это — наследственная оптическая нейропатия Лебера (Leber hereditary optic neuropathy, LHON) и амавроз зрительного нерва Лебера (Leber congenital amaurosis, LCA). В 1957 году шведский психиатр Карл-Генри Альстрём предположил, что описанная Лебером слепота наследуется аутосомно-рецессивно.
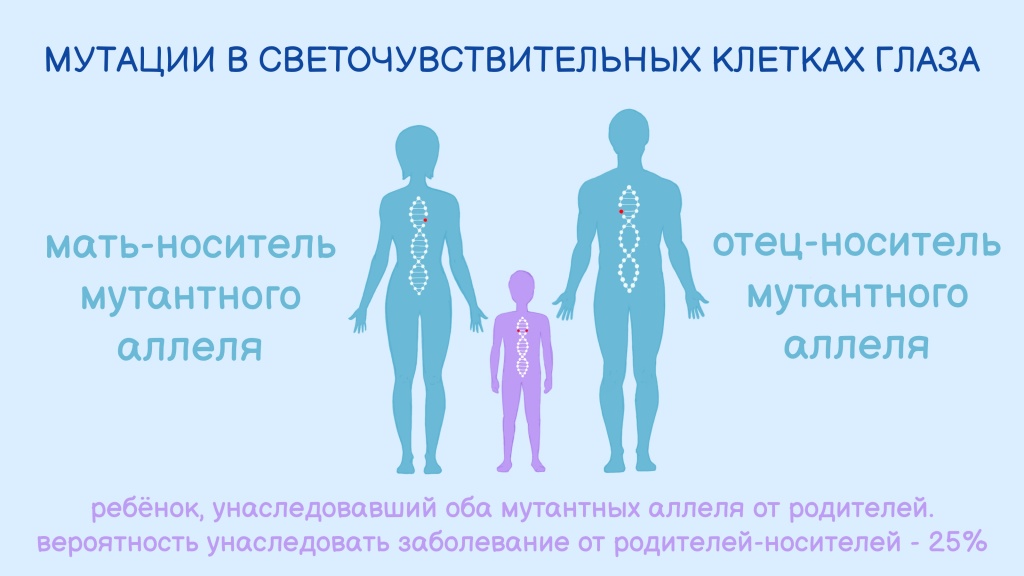
То есть ген с ошибкой унаследован от обоих родителей, и половая принадлежность здесь не при чем — этот ген расположен не в половых хромосомах (не в X, и не в У). Просто мужчина и женщина оказались его носителями, причем клинические признаки заболевания у них, вероятно, отсутствовали.
Риск, что ребенок такой пары родится с наследственным заболеванием, например, амаврозом Лебера, составляет 25%.
Схема аутосомно-рецессивного типа наследования врожденного амавроза Лебера
В 1992 году Олаф Рисс с коллегами подтвердили аутосомно-рецессивный характер наследования заболевания, проанализировав 23 семьи, в которых встречался амавроз Лебера. В 1995 году Аньес Камузат с коллегами обнаружили на 17 хромосоме ген, ассоциированный с развитием слепоты, — они обозначили его как LCА1.
Врожденный амавроз Лебера — это группа заболеваний?
На сегодняшний день известно как минимум 400 мутаций в 25 генах, приводящих к врожденому амаврозу Лебера. Эти генетические ошибки обнаруживаются у 70-80% пациентов — у части пациентов с клинической картиной и офтальмологическими признаками этого заболевания так и не удается найти мутацию. Выделяют 19 типов амавроза Лебера — по типу обнаруженной мутации. Каждому типу присваиваются порядковые номера — от LCA1 до LCA19. Наиболее распространенный (5-10% всех случаев), хорошо изученный с молекулярной точки зрения и имеющий генетическую терапию — это второй тип — LCA2. При этом типе происходит мутация в гене RPE65.
Как ошибки в гене влияют на зрение?
Основной механизм возникновения заболевания можно объяснить тем, что в особых светочувствительных клетках глаза — палочках и колбочках, которые преобразуют световой импульс в нервный сигнал, воспринимаемый головным мозгом, происходит нарушение зрительного цикла. При мутациях эти светочувствительные клетки погибают и перестают преобразовать сигнал, что ведет к прогрессирующей потере зрения. Лучше всего такой патогенетический механизм изучен при мутации в гене RPE65. При этой мутации есть дефицит или полностью отсутствует фермент, который поддерживает зрительный цикл.
Без фермента разрывается цепочка последовательных химических реакций, необходимых для перевода светового импульса в «зрительную картинку», и чем меньше этого фермента, тем хуже становится зрение.
Можно ли вылечить врожденную слепоту?
Современная диагностика врожденного амавроза Лебера основана на стандартных офтальмологических методах обследования — это клинический осмотр, визометрия, авторефрактометрия. Также необходимы специальные методы — электрофизиологическое исследование, исследование полей зрения и применение оптической когеретной томографии. Также врачу необходимо собрать подробный анамнез, узнать семейную историю заболевания и провести генетическое тестирование. Зачем оно нужно?
Знание точной мутации может кардинально изменить лечение амавроза Лебера, ведь это одно из немногих «редких» заболеваний, для которого разработана генная терапия. То есть неправильно работающий ген, из-за которого возникло заболевание, можно исправить.
Генная терапия — это единственный метод лечения, который влияет на причину заболевания. До ее появления все лечение сводилось к поддерживающим методам — применению витаминов и препаратов, влияющих на кровоснабжение глаз, но они лишь слегка замедляли неизбежное — потерю зрения. Почему же глаза идеально подходят для генной терапии? Все дело в особенностях строения и расположения глаза. Так:
- глаза — легкодоступный орган для проведения манипуляций, в отличие от, например, печени или мышц;
- исправить ген нужно в сравнительно небольшом количестве клеток;
- гемато-ретинальный барьер (особая структура, которая предотвращает проникновение лишних веществ в ткань сетчатки) позволяет ограничить распространение генной терапии вне глаза и снизить вероятность иммунного ответа, который может возникнуть из-за лечения.
Как работает первый и единственный препарат против поломки гена, ответственного за слепоту?
В 2017 году одно из самых влиятельных агентств в мире — управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) — одобрило первый в мире препарат для лечения наследственных заболеваний сетчатки — Luxturna (Люкстурна). Он предназначен для людей с мутацией в гене RPE65 ( о нем мы говорили чуть выше). Как работает Люкстурна? Под сетчатку каждого глаза проводится инъекция нормальной «рабочей» копии гена RPE65. Эта манипуляция позволяет доставить нужный ген непосредственно в клетки сетчатки глаза. Для такой доставки используется специальный курьер — природный адено-ассоциированный вирус, его называют вектором (Adeno-associated dependoparvovirus, AAV). Доставленный ген начинает производить фермент, необходимый для зрительного цикла.
Схема генной терапии
Разработка препарата велась с 1995 года. Первые доклинические испытания проводились на собаках, которые имели ранние и тяжелые нарушения зрения и мутацию в обеих копиях гена RPE65. Эти исследования показали, что вводимая генно-инженерная конструкция не токсична, приводит к значительному улучшению зрения и останавливает гибель светочувствительных клеток. Дальше — на следующей фазе — клинические исследования проводились уже на людях.
Всем ли подойдет генная терапия?
Обязательное условие для терапии — это сохранность фоторецепторов (светочувствительных клеток), так как Люкстурна не может заново «построить» новые палочки и колбочки — препарат может только поддерживать зрительный цикл в сохранившихся клетках. Есть и побочные эффекты — боль и отечность глаз, катаракта и повышение внутриглазного давления.
Один из участников клинических исследований — старшеклассник Кристиан Гуардино — так описывал свое состояние после лечения: «Моя жизнь намного улучшилась», а его мать Бет Гуардино дополнила: «Теперь он может выходить на улицу в сумерки, чего не мог раньше, и он впервые увидел звезды. И он может читать мое выражение лица и знать, счастлива я или нет».
Идут разработки и клинические исследования и других препаратов, которые пытаются исправить мутации не только в гене RPE65, но и остальных — например, в гене фоторецептора CEP290.В 2016 году в России появилась межрегиональная общественная организация — «Чтобы видеть». Ее цель — помочь детям и взрослым с различными наследственными заболеваниями сетчатки, приводящими к сильному ухудшению зрения вплоть до его полной потери. На портале представлена информация о заболеваниях, возможностях их диагностики и терапии, устройстве быта и вспомогательных средствах, которые могут облегчить жизнь слабовидящим людям. Порядка 40 млн слепых людей во всем мире нуждаются в технологиях, которые могут вернуть способность видеть. Однако до сих пор не существует доступного способа протезирования зрения
Мы привыкли ассоциировать зрение лишь с глазами. Однако помимо самих глазных яблок в процессе участвует зрительная кора головного мозга, которой мы фактически «видим», и нервные пути, которые соединяют глаза с мозгом. Практически на каждом этапе можно попытаться реализовать протезирование.
История создания зрительного протеза
Немецкий психолог Иоганн Пуркинье в 1823 году заинтересовался вопросами зрения и галлюцинаций, а также возможностью искусственной стимуляции зрительных образов. Принято считать, что именно он впервые описал зрительные вспышки — фосфены, которые он получил при проведении простого опыта c аккумулятором, пропуская через голову электрический ток и описывая свой визуальный опыт.
Спустя 130 лет, в 1956 году, австралийский ученый Дж. И. Тассикер запатентовал первый ретинальный имплант, который не давал какого-то полезного зрения, но показал, что можно искусственно вызывать зрительные сигналы.
Ретинальный имплант (имплант сетчатки) «вводит» визуальную информацию в сетчатку, электрически стимулируя выжившие нейроны сетчатки. Пока вызванные зрительные восприятия имели довольно низкое разрешение, но достаточное для распознавания простых объектов.
Но глазное протезирование долго тормозилось из-за технологических ограничений. Прошло очень много времени, прежде чем появились какие-то реальные разработки, которые смогли дать «полезное зрение», то есть зрение, которым человек мог бы воспользоваться. В 2019 году в мире насчитывалось около 50 активных проектов, фокусирующихся на протезировании зрения.
Первые ретинальные импланты
Пару лет назад на рынке было доступно три ретинальных импланта, которые прошли клинические испытания и были сертифицированы государственными регулирующими органами: европейским CE Mark и американским FDA.
- Second Sight Medical Products, США
- Pixium Vision, Франция
- Retina Implant AG, Германия
Так выглядели первые ретинальные импланты
Бионические импланты — это целая система внешних и внутренних устройств.
IRIS II (Pixium Vision) и Argus II (Second Sight) имели внешние устройства (очки с видеокамерой и блок обработки видеосигнала). Слепой человек смотрит при помощи камеры, с нее картинка направляется в процессор, где изображение обрабатывается и распадается на 60 пикселей (для системы Argus II). Затем сигнал направляется через трансмиттер на электродную решетку, вживленную на сетчатке, и электрическим током стимулируются оставшиеся живые клетки.
В немецком импланте Alfa АMS (Retina Implant) нет внешних устройств, и человек видит своим собственным глазом. Имплант на 1600 электродов вживляется под сетчатку. Свет через глаз попадает на светочувствительные элементы и происходит стимуляция током. Питается имплант от подкожного магнитного коннектора.
Субретинальный имплантат Alpha AMS компании Retina Implant AG
Все три ретинальных импланта больше не производятся, так как появилось новое поколение кортикальных протезов (для стимуляции коры головного мозга, а не сетчатки глаза). Однако хотя проектов по фундаментальным разработкам по улучшению ретинальных имплантов еще много, ни один из них не прошел клинические испытания:
- Улучшенный имплант DRY AMD PRIMA компании Pixium с увеличением количества электродов для стимуляции большего количества клеток сетчатки проходит клинические испытания. Для участия в программе испытаний еще ищут пять кандидатов;
- Retina Implant AG закрыли производство;
- Second Sight проводят клинические испытания своего кортикального импланта, но в марте 2020 года компания уволила 80% сотрудников из эксплуатационно-производственного подразделения.
Тренды ретинальных имплантов: основные фундаментальные технологии
Ретинальные нанотрубки
Группа ученых из Китая (Shanghai Public Health Clinical Center) в 2018 году провела эксперимент на мышах, в ходе которого вместо не функционирующих фоторецепторов сетчатки предложила использовать нанотрубки. Преимущество этого проекта — маленький размер нанотрубок. Каждая из них может стимулировать только несколько клеток сетчатки.
Биопиксели
Группа ученых из Оксфорда стремится сделать протез максимально приближенным к естественной сетчатке. Биопиксели в проекте выполняют функцию, схожую с настоящими клетками. Они имеют оболочку из липидного слоя, в который встроены фоточувствительные белки. На них воздействуют кванты света и как в настоящих клетках изменяется электрический потенциал, возникает электрический сигнал.
Перовскитная искусственная сетчатка
Все предыдущие фундаментальные разработки направлены на стимулирование всех слоев живых клеток. При помощи технологии перовскитной искусственной сетчатки китайские ученые пытаются предоставить возможность не только получать световые ощущения, но и различать цвет за счет моделирования сигнала таким образом, чтобы он воспринимался мозгом как имеющий определенную цветность.
Фотогальваническая пленка Polyretina
В Polyretina используется маленькая пленка, покрытая слоем химического вещества, которое имеет свойство поглощать свет и конвертировать его в электрический сигнал. Пленка размещена на сферическом основании, чтобы можно было удобно разместить ее на глазном дне.
Фотогальванический имплант Polyretina
Субретинальное введение полупроводникового полимера
Итальянские ученые предлагают технологию введения полупроводникового полимерного раствора под сетчатку, при помощи которого свет фиксируется и трансформируется в электрические сигналы.
Российский опыт ретинального протезирования
В России в 2017 году при поддержке фондов «Со-единение» и «Искусство, Наука и Спорт» было приобретено и установлено два ретинальных импланта Argus II американской компании Second Sight. Это единственные операции по восстановлению зрения, которые были проведены в России за все время. Каждая операция вместе с реабилитацией стоила порядка 10 млн руб, а сама система имплантации для одного пациента — порядка $140 тыс. Все прошло успешно, и два полностью слепых жителя Челябинска — Григорий (не видел 20 лет) и Антонина (не видела 10 лет) — получили предметное зрение. Предметное зрение означает, что человек может видеть очертания предметов — дверь, окно, тарелку — без деталей. Читать и использовать смартфон они не могут. Оба пациента имели диагноз «пигментный ретинит» (куриная слепота).
На момент 2019 года в мире установлено около 350 имплантов, произведенных компанией Second Sight. Около 50 тысяч россиян нуждаются в подобном протезе сетчатки.
В России опытом в протезировании зрения может похвастаться лишь один проект — АНО Лаборатория «Сенсор-Тех».
«Трендом в фундаментальных разработках бионических протезов является стремление сделать их максимально безопасными, приближенными к биологическим тканям людей и с максимально возможным разрешением. Но настоящую революцию вызвали кортикальные импланты, и смысл в ретинальных имплантах пропал, так как они ставятся только при пигментном ретините и возрастной макулярной дегенерации при отсутствии ряда противопоказаний. Кортикальные же импланты значительно расширяют горизонт показаний и позволяют восстанавливать полезное зрение даже людям, вовсе лишенным глаз», — рассказал Андрей Демчинский, к.м.н., руководитель медицинских проектов АНО Лаборатория «Сенсор-Тех».
Кортикальные системы имплантации
Кортикальные протезы — это подгруппа визуальных нейропротезов, способных вызывать зрительные восприятия у слепых людей посредством прямой электрической стимуляции затылочной коры мозга, которая отвечает за распознавание изображений. Этот подход может быть единственным доступным лечением слепоты, вызванной глаукомой, терминальной стадией пигментного ретинита, атрофией зрительного нерва, травмой сетчатки, зрительных нервов и т.п. За последние пять лет ученые решили задачу создания такого внутрикортикального визуального нейропротеза, с помощью которого можно было бы восстановить ограниченное, но полезное зрение.
В 1968 году Г.С. Бридли и В.С. Левин провели первую операцию по установке кортикальных имплантов. Первый имплант состоял из шапочки с коннекторами (устанавливали на череп под кожу) и отдельной дуги с электродами (устанавливали под череп), которые стимулировали кору головного мозга. Эксперимент был проведен на двух добровольцах для оценки возможности получения полезного зрения. Позднее импланты были извлечены. Технология кортикальных имплантов была заморожена по причине провоцирования приступов эпилепсии при стимуляции большего количества клеток мозга.
Первый кортикальный имплант
Кортикальный имплант Orion
Спустя 45 лет американский лидер разработки ретинальных имплантов Second Sight создал кортикальную протезную систему ORION. В конце 2017 года Second Sight получили разрешение от Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) на проведение клинических испытаний. До апреля 2018 года было установлено шесть устройств. По результатам испытаний оказалось, что все пациенты ощущали зрительные стимулы, a у трех пациентов результаты были схожи с ретинальным имплантом Argus II и дали полезное предметное зрение. Клинические испытания будут проходить до июня 2023 года. Обязательным условием установки импланта является наличие у пациента зрительного опыта, то есть он может использоваться только для людей со сформированной зрительной корой, которые родились зрячими и потеряли зрение.
Система кортикальной имплантации Orion компании Second Sight
Кортикальный нейропротез CORTIVIS
Испанские ученые разработали кортикальный имплант под названием CORVITIS. Протез состоит из нескольких компонентов. Одна или две камеры обеспечивают получение изображения, которое затем обрабатывается биопроцессором, чтобы преобразовать визуальный образ в электрические сигналы. На втором этапе информация сводится в серию изображений и передается по радиочастотной связи на имплантированное устройство. Этот радиочастотный блок обеспечивает беспроводную передачу питания и данных во внутреннюю систему. Имплантированный электронный блок декодирует сигналы, определяет и контролирует форму напряжения и амплитуду формы волны, которая будет подаваться на соответствующие электроды. Клинические испытания на пяти пациентах завершатся в мае 2023 года.
Кортикальный имплант CORVITIS
Интракортикальный зрительный протез (WFMA)
Американские ученые разработали технологию многоканальной внутрикортикальной стимуляции с помощью беспроводных массивов металлических микроэлектродов и создали беспроводную плавающую микроэлектродную решетку (WFMA).
Система протеза состоит из группы миниатюрных беспроводных имплантируемых решеток-стимуляторов, которые могут передавать информацию об изображении, снятом на встроенную в очки видеокамеру, непосредственно в мозг человека. Каждая решетка получает питание и цифровые команды по беспроводной связи, так что никакие провода или разъемы не пересекают кожу головы. Посылая команды в WFMA, изображения с камеры передаются непосредственно в мозг, создавая грубое предметное визуальное восприятие изображения. Хотя восприятие не будет похоже на нормальное зрение, с его помощью человек может вести самостоятельную деятельность. Система ICVP получила одобрение FDA для проведения клинических испытаний.
Интракортикальный зрительный протез (WFMA)
Кортикальный протез NESTOR
Голландские ученые также разработали схожую технологию системы протезирования. Принцип функционирования протеза такой же, как в проектах выше. Камера отправляет сигнал на имплант, который состоит из тысяч электродов и смарт-чипа. С помощью процессора зрительное восприятие можно контролировать и регулировать.
«Хотя полное восстановление зрения пока кажется невозможным, кортикальные системы создают по-настоящему значимые визуальные восприятия, при помощи которых слепые люди могут распознавать, локализировать и брать предметы, а также ориентироваться в незнакомой среде. Результат — в существенном повышении уровня жизни слепых и слабовидящих. Такие вспомогательные устройства уже позволили тысячам глухих пациентов слышать звуки и приобретать языковые способности, и такая же надежда существует в области визуальной реабилитации», — обнадежил Андрей Демчинский.
Обновлено 14.08.2020
Миопия (более знакома всем как близорукость) – это состояние оптики глаза, при котором человек плохо видит вдаль. Правильно будет отметить, что это не болезнь, а особенность строения человеческого глаза, размеры которого превышают среднестатистическую норму, или же глаз обладает повышенной преломляющей способностью за счет «крутой» (иначе говоря, «выпуклой») роговицы глаза (передней прозрачной поверхности глаза).
Так сложилось, что вся планета эволюционирует в сторону миопии, т.е. с каждым годом число близоруких растет в геометрической прогрессии. Но при всей этой устрашающей статистике офтальмологи всего мира по сей день ломают голову о причинах возникновения миопии, а также над способами профилактики и лечения этого состояния.
А теперь немного о хорошем: так сложилось, что в нашей стране «дела» с миопией обстоят не так «плохо», как например, в странах Восточной и Юго-восточной Азии, где распространенность миопии достигает порядка 84% у учащихся старших классов (т.е. из 10 учеников – 8 близоруких). И в большинстве своем нашим деткам (спросите, почему деткам? – потому что в основном именно в детском возрасте прогрессирует миопия) ничего не грозит, за исключением необходимости пользоваться очками для получения хорошего зрения. Лишь небольшой процент случаев миопии нуждается в активных действиях со стороны офтальмологов – это детки с быстро прогрессирующей миопией (более 1 Дптр/год). И здесь возникает извечный вопрос «что делать?» Как уже было сказано выше, до сих пор все причины возникновения миопии не сформулированы. Наследственная предрасположенность рассматривается, как одна из основных. В этом случае немаловажную роль имели бы профилактические меры. В качестве профилактики миопии доказана роль прогулок на свежем воздухе под воздействием солнечного света (в глазу происходят сложные физико-химические реакции, тормозящие рост глаза). Часто в качестве «угрозы» рассматриваются различные электронные гаджеты. Так вот на сегодняшний день убедительных данных в пользу этой «теории» до сих пор не найдено, ученые больше склоняются к дефициту тех самых «полезных прогулок на свежем воздухе» в счет проведения времени за гаджетами. Также отмечается роль необходимости частых перерывов во время работы с этими устройствами, нежели сокращение до минимума контакта с ними.
Говоря о лечении уже развившейся и быстро прогрессирующей миопии, надо отметить, что в этом вопросе, к сожалению, взгляды отечественных офтальмологов расходятся с общепринятыми в мировой офтальмологии. На сегодняшний день достоверно доказанными и эффективными (эффективность по разным научным данным порядка 40-60%; не 100%, увы, но и это успех!) являются 2 метода: лечебная атропинизация и ортокератологические линзы. Поговорим вкратце о каждом.
Атропинизация – это ежедневное закапывание в глаза капель атропина в определенной концентрации (на сегодняшний день рекомендуемой концентрацией является -0.01%). Это лечение длительное (не редко, более года, а то и двух лет) с минимальным процентом (практически «0») побочных эффектов по результатам многих зарубежных многолетних исследований. И этот метод считается самым эффективным и безопасным методом лечения прогрессирующей миопии на сегодняшний день. Однако, этот «волшебный» метод до сих пор не зарегистрирован в нашей стране в качестве рекомендуемого метода лечения прогрессирующей миопии. Увы и ах!..
Ортокератологические линзы (ОК-, ночные линзы) – это метод коррекции зрения, который также показал успешные результаты в решении вопроса торможении миопии. Эти линзы надеваются на ночь, в течение которой меняется профиль роговицы (вернее, эпителия роговицы), в результате чего изменяется оптика глаза, и после снятия линз человек видит хорошо без необходимости в дополнительных очках или линзах. Но этот эффект обратим, и необходимо ежедневное надевание линз на ночь для получения хорошего зрения в течение всего последующего дня. И главное – использование этих линз сопряжено с риском инфекционных осложнений на глазах. Но при соблюдении всех гигиенических норм использования, чистки, хранения этих линз, этот риск сводится к минимуму. Данный метод разрешен и рекомендован в нашей стране.
И, конечно же, нельзя умолчать об отечественных рекомендациях: склеропластика (хирургическое «укрепление» заднего отдела глазного яблока), аппаратное лечение (тренажеры для глаз), использование капель (как например, Ирифрин), гимнастика для глаз – эти методы не нашли свое место в общепринятых во всем мире «доказательных» рекомендациях по профилактике и лечению прогрессирующей миопии. И нигде, кроме как в нашей стране (возможно, еще и в некоторых странах бывшего СНГ), не применяются.
Всем добра и хорошего зрения!
Филип Барлоу, художник в своих работах отразил картину мира близорукого человека (www.philipbarlow.com)
Доктор медицинских наук Татьяна Шилова рассказала, что при постковидном синдроме иногда перестают видеть даже те, у кого никогда не было проблем с глазами.

Фото © Shutterstock

Татьяна Шилова
врач-офтальмолог высшей категории, профессор, доктор медицинских наук
Почему от ковида можно ослепнуть
“Глаз — это условно часть мозга, он кровоснабжается мельчайшими артериями и венами, в глазу находится самая мелкая сосудистая сеть, поэтому если возникают любые сосудистые нарушения в виде тромбозов, венозная недостаточность либо артериальный тромбоз, то тогда мы говорим об ишемическом состоянии. То есть на бытовом уровне можно говорить о том, что случается инсульт или инфаркт на глазном дне. Фактически то же самое, что происходит в мозге, происходит внутри глаза. И в этом случае человек замечает значительное ухудшение зрения”.
“Всё это усугубляется на фоне общесоматических заболеваний, таких как диабет, гипертония, атеросклероз, то есть тех заболеваний, при которых повреждается сосудистая стенка. То есть эти проблемы и раньше существовали, но ковид их усугубил”.
“Очень важно понимать, что эта проблема не связана ни с очками, ни с плюсом, ни с минусом, то есть это отдельная проблема. Она встречается у людей любого возраста, то есть даже, в принципе, это может случиться и у детей, переболевших ковидом, если инфекция была сопряжена с повреждением сосудов. И это бывает и у людей со 100-процентным зрением. Часто человек говорит, что у него никогда не было проблем с глазами. Это неважно. Это случается и на фоне полного благополучия, то есть человек был зрячим, а становится слабовидящим”.
Как люди теряют зрение за пару часов

Фото © Shutterstock
“Степень ухудшения зрения зависит от “калибра” сосуда, который был повреждён. Если это магистральные стволы, то мы говорим о центральной артерии сетчатки или тромбозе центральной вены сетчатки. Эта патология тяжёлая, и потеря зрения случается буквально в течение нескольких часов. То есть человек может заметить ухудшение зрения и за пару часов потерять зрение совсем, даже светоощущение”.
“Если повреждён не магистральный ствол, а веточка, то человек замечает частичное снижение зрения. Или тёмное пятно, например, в поле зрения. То есть он может продолжать, допустим, читать и видеть вдаль, но при этом какая-то зона в его поле видится или нечётко, или расплывчато, или патология проявляется в виде чёрного пятна”.
Как ковид вызывает глазное кровоизлияние
“При ковиде довольно часто возникает и так называемый ДВС-синдром, дефект внутрисосудистого свёртывания. Кровь, с одной стороны, плохо сворачивается, а с другой стороны — если случается кровоизлияние, то плохо останавливается. Этот синдром очень опасен”.
“Кроме того, если ковид проходит по классической схеме, когда запускаются иммунные реакции, то сосудистая стенка становится более хрупкой, как при атеросклерозе, достаточно небольшого колебания артериального давления — и происходит разрыв этой сосудистой стенки”.
“Лечение препаратами тоже влияет. При ковиде назначают и стероидные медикаменты, и большое количество лекарств, которые влияют на свёртывание крови и провоцируют повышение артериального давления. Есть группа гормональных препаратов, они назначаются с целью подавить иммунную систему и избежать осложнений. Но они имеют и свои побочные эффекты, то есть приходится из двух зол выбирать меньшее”.
Почему человек может ослепнуть и через полгода после ковида
Фото © Shutterstock
“Большинству людей, которые перенесли ковид в средней и тяжёлой форме, на определённый промежуток времени, иногда на довольно длительный, назначают антикоагулянты, то есть препараты, которые влияют на свёртывание крови. И у таких людей, по сути, свёртывающая система не способна образовать вот этот сгусток, который не даёт крови распространяться на большую площадь, поэтому такие кровоизлияния происходят не только в сетчатке, но и под сетчаткой, внутри стекловидного тела”.
“Поэтому эта проблема возникает не только на острой стадии заболевания, но и в постковидном периоде, то есть через несколько месяцев или даже, условно говоря, полгода мы встречаем пациента, у которого возникают тромбозы либо ишемические состояния на глазном дне”.
Как часто ковид приводит к потере зрения
“Сейчас такие патологии встречается гораздо чаще, чем, скажем, два года назад, то есть фактически еженедельно мы имеем по десятку пациентов с такой патологией. Но я уверена, что такие пациенты обращаются не только в клиники хирургического профиля, они приходят и по скорой помощи, кого-то привозят с острыми нарушениями кровообращения в системе зрительного нерва”.
Опасен ли для глаз “омикрон”?
Фото © Shutterstock
“Нам кажется, что “омикрон” более контагиозен в плане проникновения через слизистую оболочку глаза. Входными воротами инфекции может быть и слизистая оболочка глаза, то есть через грязные руки, контактные линзы. И поскольку у него больше белков, которые позволяют проникнуть глубже, и на него, к сожалению, не реагируют антитела, которые вырабатываются при стандартной вакцинации”.
“По моему собственному опыту, сосудистых проблем стало больше на фоне “омикрона”. Количество обращений увеличилось, патология стала более тяжёлой”.
Симптомы ухудшения зрения из-за сосудов: “раздавленный помидор” и “вишнёвая косточка”
“Клиническая картина этого процесса очень многоплановая. Могут быть мелкие мушки, могут быть крупные мушки, может быть ухудшение остроты зрения в целом, даже цветовая картинка может меняться”.
“На глазном дне есть такие типичные симптомы, которые случаются при тромбозе, мы называем это картиной раздавленного помидора, потому что масса кровоизлияний, даже зрительный нерв не видит, то есть происходят усиленные разнокалиберные кровоизлияния, как языки пламени”.
“А при ишемическом состоянии мы называем это синдромом вишнёвой косточки, то есть, наоборот, на такой молочно-белой сетчатке небольшая зона выглядит как красное пятно”.
“Кстати, такие процессы часто двусторонние, если такое случилось на одном глазу, то высока вероятность и есть статистические данные, что более половины людей подвержены этому процессу на парном глазу”.
Как врачи пытаются вернуть зрение пациенту

Фото © Shutterstock
“В целом такие проблемы лечатся так же, как инфаркты и инсульты, то есть чем раньше человек обращается за медицинской помощью, тем лучше. Конечно, вначале нужно обратиться к офтальмологу, но если по скорой помощи вызывается врач и он получает жалобу на резкое снижение зрения, то человека забирают по скорой и лечат так же, как при инфаркте и инсульте”.
“В первые часы, первые сутки мы пытаемся как бы растворить этот тромб, даём препараты, которые влияют на сосудистую свёртываемость, на вязкость, текучесть крови. И вплоть до нескольких дней мы лечим консервативно”.
“В дальнейшем есть хирургические процедуры, когда мы внутрь глаза вводим препараты, которые растворяют этот тромб, так называемые фибринолитики, в полость стекловидного тела вводится ряд препаратов, которые обладают сосудистой активностью”.
“Если это уже более поздние стадии, то отрабатываются лазером ишемические зоны, то есть лечение комбинированное в зависимости от сопутствующей патологии, от стадии заболевания, от того, насколько крупный ствол повреждён, в общем, тут очень много различных факторов”.
Будет ли снова видеть человек?
“Прежнего зрения уже не будет, а процент восстановления зависит от сроков, сопутствующих заболеваний. При артериальных проблемах прогнозы хуже, потому что артериальные ишемические состояния нередко заканчиваются полной потерей зрения. Если это венозный тромбоз и вовремя назначено лечение, то частично человек может восстановить зрение. Если это повреждение веточки отдельной, то иногда мы достигаем очень высоких показателей выздоровления”.
Когда идти к офтальмологу
“Степень восстановления зрения зависит от того, насколько быстро человек обратился к нам, потому что у сосудов внутри глаза нет так называемого анастомоза, то есть соединений, которые есть у сосудов других органов. То есть, по сути, если эта ветка затромбировалась, то появляется ишемический участок, то есть зона, которая не кровоснабжается, и нервные клетки сетчатки начинают гибнуть, отмирают”.
“Если человек заметил ухудшение зрения, будь то вдаль или вблизи, если он заметил какие-то плавающие помутнения перед глазом, даже если изменилась оптическая сила стёкол и очковые линзы не помогают, то это повод обратиться к врачу”.
Коронавирус мозга: Ковид оказался опаснее болезни Альцгеймера
Комментариев: 1
Для комментирования авторизуйтесь!